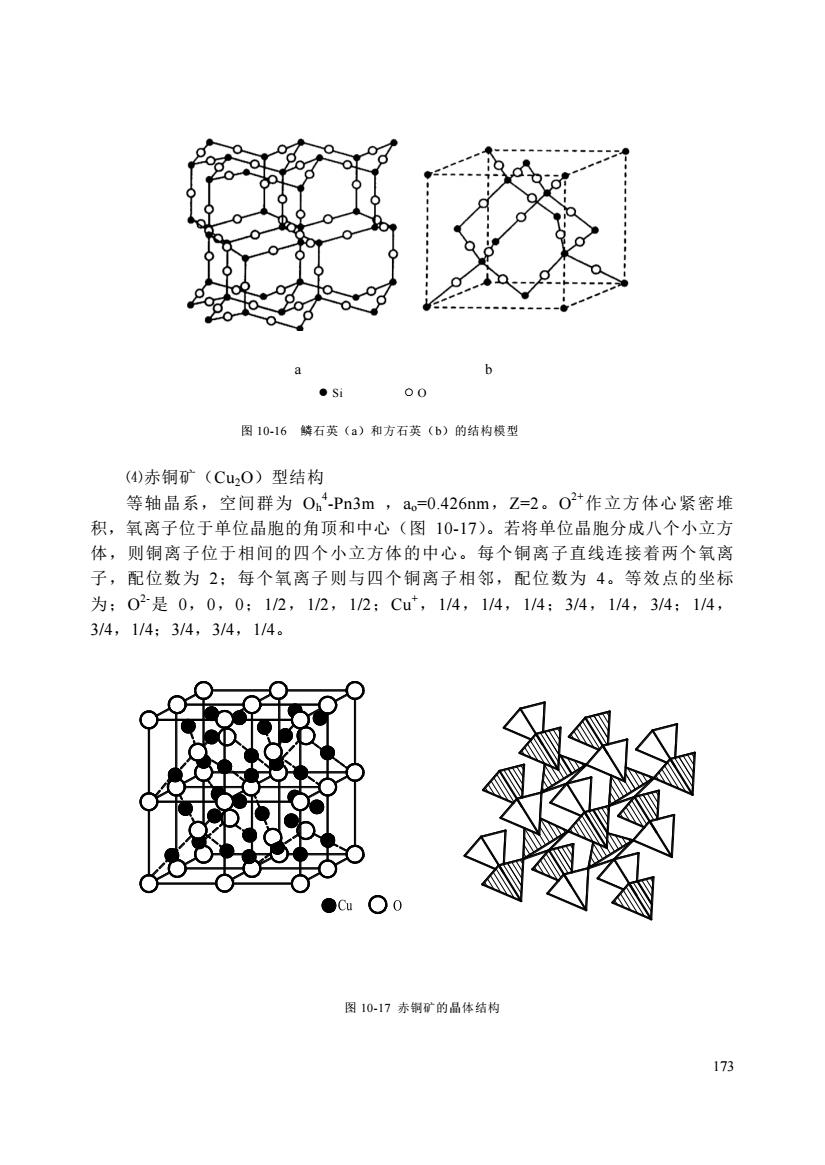
b00osi图10-16鳞石英(a)和方石英(b)的结构模型(4)赤铜矿(Cu2O)型结构等轴晶系,空间群为Oh-Pn3m,a。=0.426nm,Z=2。O2+作立方体心紧密堆积,氧离子位于单位晶胞的角顶和中心(图10-17)。若将单位晶胞分成八个小立方体,则铜离子位于相间的四个小立方体的中心。每个铜离子直线连接着两个氧离子,配位数为2:每个氧离子则与四个铜离子相邻,配位数为4。等效点的坐标为02是0,0,0:1/2,1/2,1/2Cut,1/4,1/4,1/4;3/4,1/4,3/4;1/4,3/4,1/4;3/4,3/4,1/4。1图10-17赤铜矿的晶体结构173
173 a b ● Si ○ O 图 10-16 鳞石英(a)和方石英(b)的结构模型 ⑷赤铜矿(Cu2O)型结构 等轴晶系,空间群为 Oh 4 -Pn3m ,ao=0.426nm,Z=2。O 2+作立方体心紧密堆 积,氧离子位于单位晶胞的角顶和中心(图 10-17)。若将单位晶胞分成八个小立方 体,则铜离子位于相间的四个小立方体的中心。每个铜离子直线连接着两个氧离 子,配位数为 2;每个氧离子则与四个铜离子相邻,配位数为 4。等效点的坐标 为;O 2-是 0,0,0;1/2,1/2,1/2;Cu+,1/4,1/4,1/4;3/4,1/4,3/4;1/4, 3/4,1/4;3/4,3/4,1/4。 图 10-17 赤铜矿的晶体结构
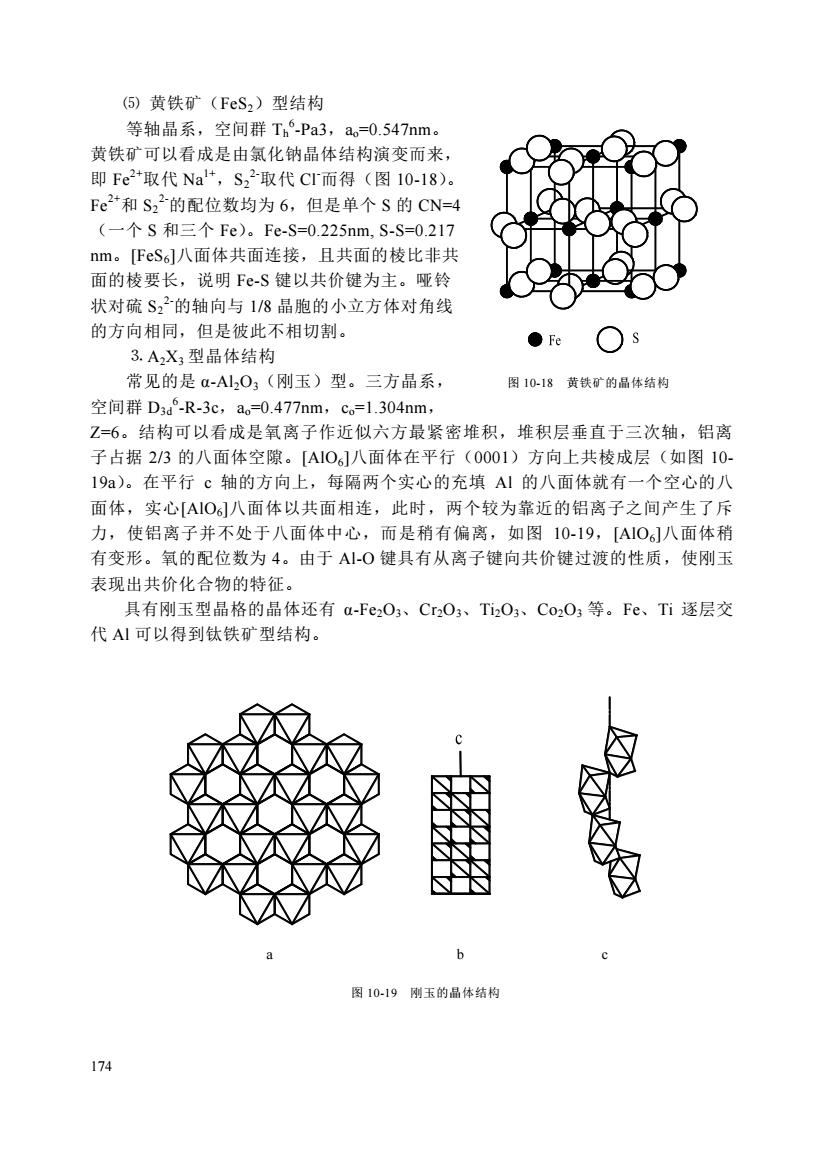
(5)黄铁矿(FeS,)型结构等轴晶系,空间群Th-Pa3,a。=0.547nm。黄铁矿可以看成是由氯化钠晶体结构演变而来,即Fe2+取代Nal+,S,2-取代CI而得(图10-18)。Fe2+和S22的配位数均为6,但是单个S的CN=4(一个S和三个Fe)。Fe-S=0.225nm,S-S=0.217nm。[FeS6l八面体共面连接,且共面的棱比非共面的棱要长,说明Fe-S键以共价键为主。哑铃状对硫S22-的轴向与1/8晶胞的小立方体对角线的方向相同,但是彼此不相切割。Fe3.A,X,型晶体结构常见的是α-Al,O3(刚玉)型。三方晶系,图10-18黄铁矿的晶体结构空间群D3d-R-3c,ao=0.477nm,c=1.304nm,Z=6。结构可以看成是氧离子作近似六方最紧密堆积,堆积层垂直于三次轴,铝离子占据2/3的八面体空隙。[AIO]八面体在平行(0001)方向上共棱成层(如图1019a)。在平行c轴的方向上,每隔两个实心的充填AI的八面体就有一个空心的八面体,实心[AIO6]八面体以共面相连,此时,两个较为靠近的铝离子之间产生了斥力,使铝离子并不处于八面体中心,而是稍有偏离,如图10-19,[A101八面体稍有变形。氧的配位数为4。由于AI-O键具有从离子键向共价键过渡的性质,使刚玉表现出共价化合物的特征。具有刚玉型晶格的晶体还有α-Fe2O3、Cr2O3、Ti2O3、Co2O等。Fe、Ti逐层交代AI可以得到钛铁矿型结构。b图10-19刚玉的晶体结构174
174 ⑸ 黄铁矿(FeS2)型结构 等轴晶系,空间群 Th 6 -Pa3,ao=0.547nm。 黄铁矿可以看成是由氯化钠晶体结构演变而来, 即 Fe 2+取代 Na1+,S2 2-取代 Cl-而得(图 10-18)。 Fe2+和 S2 2-的配位数均为 6,但是单个 S 的 CN=4 (一个 S 和三个 Fe)。Fe-S=0.225nm, S-S=0.217 nm。[FeS6]八面体共面连接,且共面的棱比非共 面的棱要长,说明 Fe-S 键以共价键为主。哑铃 状对硫 S2 2-的轴向与 1/8 晶胞的小立方体对角线 的方向相同,但是彼此不相切割。 ⒊ A2X3 型晶体结构 常见的是 α-Al2O3(刚玉)型。三方晶系, 图 10-18 黄铁矿的晶体结构 空间群 D3d 6 -R-3c,ao=0.477nm,co=1.304nm, Z=6。结构可以看成是氧离子作近似六方最紧密堆积,堆积层垂直于三次轴,铝离 子占据 2/3 的八面体空隙。[AlO6]八面体在平行(0001)方向上共棱成层(如图 10- 19a)。在平行 c 轴的方向上,每隔两个实心的充填 Al 的八面体就有一个空心的八 面体,实心[AlO6]八面体以共面相连,此时,两个较为靠近的铝离子之间产生了斥 力,使铝离子并不处于八面体中心,而是稍有偏离,如图 10-19,[AlO6]八面体稍 有变形。氧的配位数为 4。由于 Al-O 键具有从离子键向共价键过渡的性质,使刚玉 表现出共价化合物的特征。 具有刚玉型晶格的晶体还有 α-Fe2O3、Cr2O3、Ti2O3、Co2O3 等。Fe、Ti 逐层交 代 Al 可以得到钛铁矿型结构。 a b c 图 10-19 刚玉的晶体结构