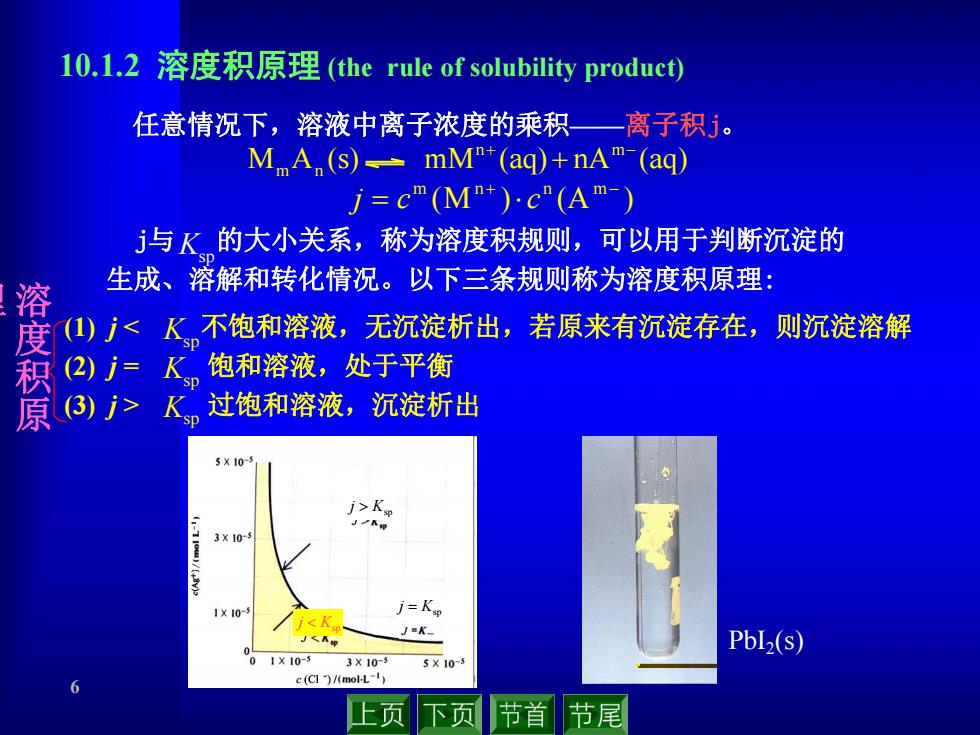
10.1.2溶度积原理(the rule of solubility product) 任意情况下,溶液中离子浓度的乘积一离子积5。 MA (s)-mM"+(ag)+nAm-(ag) j=c"(M+)c"(Am-) j与K的大小关系,称为溶度积规则,可以用于判断沉淀的 生成、溶解和转化情况。以下三条规则称为溶度积原理: 溶 (1)了<K不饱和溶液,无沉淀析出,若原来有沉淀存在,则沉淀溶解 (2)j=Ksp 肉 饱和溶液,处于平衡 K。过饱和溶液,沉淀析出 5X10-1 j>K 3X10- 1X10- j=Ksp <K J=K- PbL2(s) 0110-5 3X10-5 5×10-5 6 c (CI )/(mol-L-1) 上页 下页 节首 节尾
6 (1) j < 不饱和溶液,无沉淀析出,若原来有沉淀存在,则沉淀溶解 (2) j = 饱和溶液,处于平衡 (3) j > 过饱和溶液,沉淀析出 M A (s) mM (aq) nA (aq) n m m n (M ) (A ) m n n m j c c 10.1.2 溶度积原理 (the rule of solubility product) 任意情况下,溶液中离子浓度的乘积——离子积j。 Ksp Ksp Ksp Ksp Ksp j Ksp j Ksp j PbI2(s) j与 的大小关系,称为溶度积规则,可以用于判断沉淀的 溶 生成、溶解和转化情况。以下三条规则称为溶度积原理: 度 积 原 理

ue 你认为沉淀平衡中和K的关系与化学 平衡中浓度商和平衡常数的关系怎样? 止页下页节首节尾
7 Question 1 你认为沉淀平衡中j和 的关系与化学 平衡中浓度商和平衡常数的关系怎样? Ksp
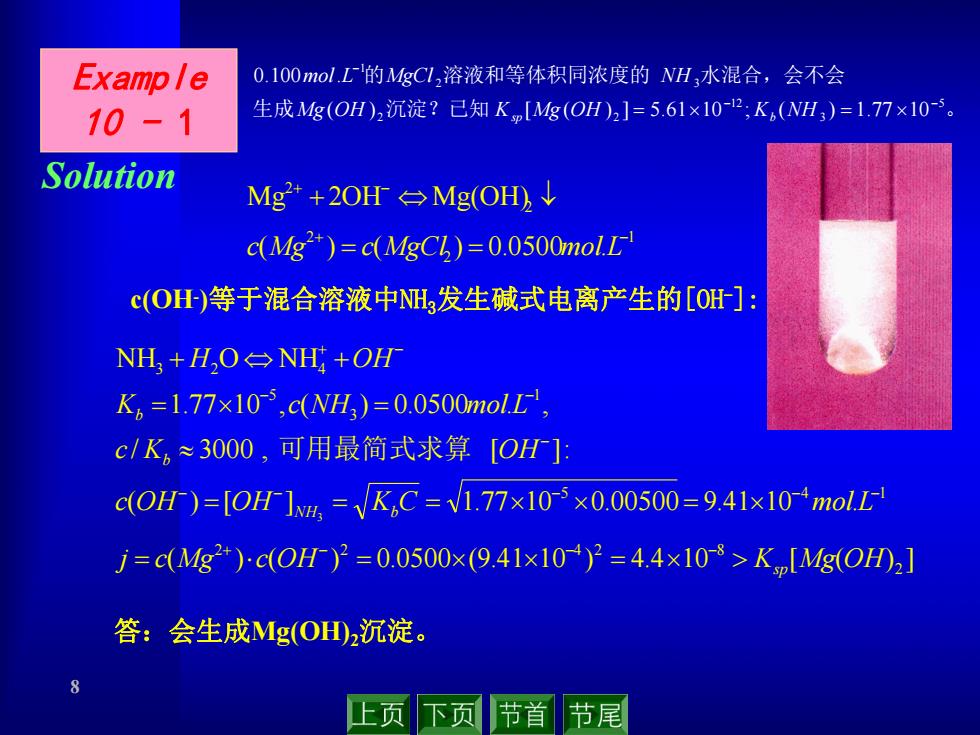
Example 0.100mol.L的MgC1,溶液和等体积同浓度的NH,水混合,会不会 10-1 生成Mg(OH)2沉淀?已知Kp[Mg(OH)2]=5.61×10-2:K,(NH,)=1.77×10。 Solution Mg*+2OH台Mg(OH)↓ c(Mg)=c(MgC)=0.0500mol.L c(O)等于混合溶液中N发生碱式电离产生的[OH]: NH,+H,O⊙NH+OH K。=1.77×10,cNH3)=0.0500molL, c/K,≈3000,可用最简式求算[OH]: c(OH)=[OH]4,=√K,C=V1.77×1035×0.00500=9.41x10molL j=cMg2+)c(OH)2=0.0500×(9.41×10°)=4.4×108>Km[Mg(OH02] 答:会生成Mg(OH2沉淀。 8 上页 下页 节首 节尾
8 1 2 2 2 2 ( ) ( ) 0.0500 . Mg 2OH Mg(OH) c Mg c MgCl mol L Example 10 - 1 Solution c(OH-)等于混合溶液中NH3发生碱式电离产生的[OH-]: 生成 沉淀?已知 。 的 溶液和等体积同浓度的 水混合,会不会 5 3 12 2 2 2 3 1 ( ) [ ( ) ] 5.61 10 ; ( ) 1.77 10 0.100 . Mg OH K Mg OH K NH mol L MgCl NH sp b 5 4 1 1 3 5 3 2 4 ( ) [ ] 1.77 10 0.00500 9.41 10 . / 3000 , [ ]: 1.77 10 , ( ) 0.0500 . , NH O NH 3 c OH OH K C mol L c K OH K c NH mol L H OH NH b b b 可用最简式求算 ( ) ( ) 0.0500 (9.41 10 ) 4.4 10 [ ( ) ] 2 2 2 4 2 8 j c Mg c OH Ksp Mg OH 答:会生成Mg(OH)2沉淀

Example 25℃时,晴纶纤维生产的某种溶液中,CS02)为6.0×10-4 moL.若在40.0L该溶液中,加入0.010 mol-L-BaCl2溶液10.0L, 问是否能生成BaSO,沉淀? Solution cS0)= 6.0×10-×40.0 '=4.8×104mol.L 50.0 c(Ba2)= 0.010×10.0 0=2.0x10-3mol-L 50.0 j=c(SO).c(Ba2) =4.8×104×2.0x10-3 =9.6×107 Kp=1,1×100 J>Kp,所以有BaSO,沉淀析出 0 上页下页 节首节尾
9 25℃时,晴纶纤维生产的某种溶液中,C(SO4 2-)为 6. 0×10-4 mol·L-.若在 40.0L该溶液中,加入 0.010 mol·L- BaCl2溶液 10.0L , 问是否能生成 BaSO4 沉淀? Example Solution sp ,所以有 4沉淀析出 10 sp 7 4 3 2 o 2 o 4 2 3 1 4 1 4 2 4 BaSO 1.1 10 9.6 10 4.8 10 2.0 10 (SO ) (Ba ) 2.0 10 mol L 50.0 0.010 10.0 (Ba ) 4.8 10 mol L 50.0 6.0 10 40.0 (SO ) j K K j c c c c

这样的操作能得 到白色Mn(OH2吗? 10 止页下页节首节尾
10 Question 2 这样的操作能得 到白色Mn(OH)2吗?