
到肯定结果,这时的浓度为最低浓度。 三、鉴定反应的选择性 一种试剂只与几种离子起反应,该反应称为选择性反应,该试 剂为选择性试剂。如果一种试剂只与一种离子起反应,则这一反 应的选择性最好,称为专属反应或特效反应,该试剂称为专属试剂 或特效试剂。一种试剂能和多种离子起反应,这种反应的选择性 就不好。 例如NH4与NaOH作用生成氨气(NH),具有特殊气味,并 使红色石蕊试纸变蓝,通常认为这是NH4的专属反应。而 K2CrO,与Pb2能生成黄色沉淀,但它亦能与Ba2+,S2+等起作 用,都能生成黄色沉淀,所以当它们同时存在时,就不能断定黄色 沉淀是不是PbCO4了,所以该反应的选择性就较差。 到目前为止,特效反应不多,而且所谓特效也并非绝对专一, 而是相对于一定条件而言的。比如鉴定NH4的反应如果在热的 NaOH介质中,CN也可以与其反应放出氨气。当Ba2+.Sr2+同 时存在时,以CO检验Ba2+,如果反应在HAc-NaAc缓冲液 中进行,由于溶液的酸度足以使CO的平衡浓度降低,进而使 SrCrO沉淀不能析出,而BaCrO,的溶解度比SrCrO,小,这时仍 能析出沉淀,从而提高了反应的选择性。 分析化学工作者一方面要努力寻求特效试剂,另一方面要创 造使干扰物质的反应不能发生的条件,这样就能使原来选择性比 较差的反应的选择性有所提高,甚至变为特效反应。 提高鉴定反应选择性的途径主要是:控制溶液的酸度,加入掩 蔽剂,分离干扰离子和附加补充试验等。后者是通过附加一些补 充试验的办法,将鉴定离子与干扰离子加以区分。必须指出,在选 择鉴定反应时,需同时考虑反应的灵敏度和选择性,应该在灵敏度 能满足要求的条件下,尽量采用选择性高的反应。 四、系统分析和分别分析 系统分析是按一定的步骤和顺序,将离子加以分组分离,然后
的平衡浓度降低,进而使 作用生成氨气( 到肯定结果,这时的浓度为最低浓度。 三、鉴定反应的选择性 一种试剂只与几种离子起反应,该反应称为选择性反应,该试 剂为选择性试剂。如果一种试剂只与一种离子起反应,则这一反 应的选择性最好,称为专属反应或特效反应,该试剂称为专属试剂 或特效试剂。一种试剂能和多种离子起反应,这种反应的选择性 就不好。 例如 与 使 红 色石 蕊 试 纸 变蓝 , 通 常 认为 这 是 与 能生成黄色沉淀,但它亦能与 沉淀是不是 用,都能生成黄色沉淀,所以当它们同时存在时,就不能断定黄色 了,所以该反应的选择性就较差。 的反应如果在热的 到目前为止,特效反应不多,而且所谓特效也并非绝对专一, 而是相对于一定条件而言的。比如鉴定 也可以与其反应放出氨气。当 同 检验 介质中, 时存在时,以 ,如果反应在 缓冲液 的溶解度比 中进行,由于溶液的酸度足以使 沉淀不能析出,而 小,这时仍 能析出沉淀,从而提高了反应的选择性。 分析化学工作者一方面要努力寻求特效试剂,另一方面要创 造使干扰物质的反应不能发生的条件,这样就能使原来选择性比 较差的反应的选择性有所提高,甚至变为特效反应。 提高鉴定反应选择性的途径主要是:控制溶液的酸度,加入掩 蔽剂,分离干扰离子和附加补充试验等。后者是通过附加一些补 充试验的办法,将鉴定离子与干扰离子加以区分。必须指出,在选 择鉴定反应时,需同时考虑反应的灵敏度和选择性,应该在灵敏度 能满足要求的条件下,尽量采用选择性高的反应。 四、系统分析和分别分析 系统分析是按一定的步骤和顺序,将离子加以分组分离,然后 ,具有特殊气味,并 的 专 属 反 应 。 而 等起作

进行鉴定。首先用不同的组试剂将溶液中性质相近的离子分成若 干组,然后在各组内进一步分离和鉴定。组试剂是能将各组离子 分开的试剂,组试剂一般是沉淀剂,采用组试剂将反应相似的离子 整组分开,可使复杂的分析任务大为简化。理想的组试剂应满足 下列要求: (1)分离完全一些离子完全沉淀,另一些离子完全进入溶 液: (2)反应迅速: (3)沉淀与溶液易于分开: (4)一个组内离子的种类不可太多,以便鉴定。 在其它离子共存时,不需要经过分组分离,直接检查待检出离 子的方法,称为分别分析法。理想的分别分析法需采用专属反应 或创造专属反应的条件。分别分析法最适于指定范围内的离子鉴 定,即对试样组成大致了解,只需确定其中某些离子是否存在时进 行的鉴定。 本书在阳离子分析中,采用系统分析法:在阴离子分析中,采 用分别分析法。在实际工作中,应灵活地将系统分析法和分别分 析法结合起来,拟定出最简便的分析方案。 五、空白试验和对照试验 定性分析中,选用的鉴定反应灵敏度都很高,但有时并不能完 全保证鉴定的可靠性,这是因为:(1)溶剂、辅助试剂或器皿等可 能引进外来离子,从而被当作试液中存在的离子而鉴定出来: (2)试剂失效或反应条件控制不当,而使鉴定反应的现象不明显 或得出否定结果。 第一种情况可通过空白试验来解决。 空白试验即是在鉴定反应的同时,另取一份配制试样溶液用 的蒸馏水代替试液,然后以同样的方法进行鉴定。 空白试验用以检查试剂或蒸馏水中是否含有被鉴定的离子。 例如在试样的HCl溶液中用NH,SCN鉴定Fe3+时得到浅红色溶
鉴定 时得到浅红色溶 进行鉴定。首先用不同的组试剂将溶液中性质相近的离子分成若 干组,然后在各组内进一步分离和鉴定。组试剂是能将各组离子 分开的试剂,组试剂一般是沉淀剂,采用组试剂将反应相似的离子 整组分开,可使复杂的分析任务大为简化。理想的组试剂应满足 下列要求: 分离完全 一些离子完全沉淀,另一些离子完全进入溶 液; 反应迅速; 沉淀与溶液易于分开; 一个组内离子的种类不可太多,以便鉴定。 在其它离子共存时,不需要经过分组分离,直接检查待检出离 子的方法,称为分别分析法。理想的分别分析法需采用专属反应 或创造专属反应的条件。分别分析法最适于指定范围内的离子鉴 定,即对试样组成大致了解,只需确定其中某些离子是否存在时进 行的鉴定。 本书在阳离子分析中,采用系统分析法;在阴离子分析中,采 用分别分析法。在实际工作中,应灵活地将系统分析法和分别分 析法结合起来,拟定出最简便的分析方案。 五、空白试验和对照试验 溶剂、辅助试剂或器皿等可 定性分析中,选用的鉴定反应灵敏度都很高,但有时并不能完 全保证鉴定的可靠性,这是因为: 能引进外来离子,从而被当作试液中存在的离子而鉴定出来; 试剂失效或反应条件控制不当,而使鉴定反应的现象不明显 或得出否定结果。 第一种情况可通过空白试验来解决。 空白试验即是在鉴定反应的同时,另取一份配制试样溶液用 的蒸馏水代替试液,然后以同样的方法进行鉴定。 溶液中用 空白试验用以检查试剂或蒸馏水中是否含有被鉴定的离子。 例如在试样的

液,表示有微量铁存在。为弄清这微量F3+是否为原试样所有, 可另取配制试液的蒸馏水和HC1溶液以同样的方法进行实验,如 得到同样的浅红色,说明此微量F3+并非原试样所有,若得到更 浅的红色或无色,说明试样中确有微量Fe3+。 第二种情况即当鉴定反应不够明显或现象异常时,往往要作 对照试验。 对照试验是用已知溶液代替试液,用同样方法进行的试验,用 以检查试剂是否失效或反应条件是否控制正确。例如,用SCl2 溶液鉴定Hg+时,未出现灰黑色沉淀,可认为无Hg+存在。但是 考虑到SnC2溶液容易被空气氧化而失效,故取少量已知Hg+溶 液,加入SnC2溶液,如未出现灰黑色沉淀,说明SnC2溶液失效, 此时应重新配制溶液。 应该指出,在定量分析中也用到空白试验和对照试验。它们 用来检验和消除系统误差。与上面讲述的相比,其含义不尽相同。 六、常见阳离子的分组及TAA简介 本章要讨论如下一些常见阳离子:Ag,Hg,Hg+.Pb2 Bi3+.C2+.Cd,As(Ⅲ.V).Sb(Ⅲ.V).Sn(Ⅱ.N).A3+.C+ Fe3+.Fe2+.M2+.Zn2+.Cd2+.N2+.Ba2+.S2+.Ca2+.Mg+ K+.Na*.NH4. 按硫化氢系统将上述阳离子进行分组,分组情况如表2-2。 由于H2S气体毒性较大,而且制备也不太方便,故目前多以 硫代乙酰胺CH CSNH2,简写为TAA)的水溶液代替H2S作沉淀 剂。硫代乙酰胺在不同的介质中加热时发生不同的水解作用,因 而它不仅可以代替H2S,而且可以代替NH4)2S或Na2S作沉淀剂 使用。 硫代乙酰胺在酸性溶液中水解生成H2S,因此硫代乙酰胺可 以代替H2S沉淀第Ⅱ组阳离子。水解反应如下: CH CSNH+HOCHCONH+HS
由于 气体毒性较大,而且制备也不太方便,故目前多以 , , 。 按硫化氢系统将上述阳离子进行分组,分组情况如表 的水溶液代替 ,因此硫代乙酰胺可 组阳离子。水解反应如下: 硫代乙酰胺( ,简写为 作沉淀 ,而且可以代替( 剂。硫代乙酰胺在不同的介质中加热时发生不同的水解作用,因 而它不仅可以代替 或 作沉淀剂 使用。 沉淀第 硫代乙酰胺在酸性溶液中水解生成 以代替 液,表示有微量铁存在。为弄清这微量 是否为原试样所有, 可另取配制试液的蒸馏水和 溶液以同样的方法进行实验,如 得到同样的浅红色,说明此微量 并非原试样所有,若得到更 浅的红色或无色,说明试样中确有微量 第二种情况即当鉴定反应不够明显或现象异常时,往往要作 对照试验。 对照试验是用已知溶液代替试液,用同样方法进行的试验,用 以检查试剂是否失效或反应条件是否控制正确。例如,用 溶液鉴定 时,未出现灰黑色沉淀,可认为无 考虑到 溶 存在。但是 溶液容易被空气氧化而失效,故取少量已知 液,加入 溶液,如未出现灰黑色沉淀,说明 溶液失效, 此时应重新配制溶液。 应该指出,在定量分析中也用到空白试验和对照试验。它们 用来检验和消除系统误差。与上面讲述的相比,其含义不尽相同。 六、常见阳离子的分组及 简介 本章要讨论如下一些常见阳离子: , , , , 、 , , , , , , , , , , , , , , , 、

表2-2阳离子硫化氢系统分组方案 组别 组试剂 组内离子 组的其它名称 稀HC Ag',Hg2',Pb2 盐酸组,银组 ⅡA(硫化物不溶于N2S):Pb2· 疏化氢组,铜银细 0.3 mol.L B,Cu2·,C A 相 (HCI) ⅡB(硫化物溶于NaS):Hg2, \UB- 一锡组) As(Ⅲ,V),Sb(Ⅲ,V),Sn(I,N (NHS A3,C3·,Fe3',Fe2+,Mn2, (NH,NHCI) Zn2,CoNi 硫化铵组,铁组 (NH)2CO (NH,+NH.CI Ba2S2Ca2 碳酸铵组,钙组 V Mg2',K',Na',NH 可溶组,钠组 煮沸则 CH CONH2+H2O=CH COO NH 在碱性溶液中水解生成S2·,可以代替Na2S使ⅡA组与ⅡB组分 离。水解反应如下: CH CSNH2 +30H-CH2COO-+NH,+S2+H2O 在氨性溶液中水解生成HS,可以代替NH4)2S沉淀第山组阳离 子。水解反应如下: NH2 CHCSNH2+2NH3=CH3-C-NH HS+NH 水解速率随溶液酸度、温度而异,温度高水解加快,一般在沸腾水 浴中进行。在碱性溶液中水解比在酸性溶液中更快。 硫代乙酰胺作为组试剂的主要特点为: (1)可以减少有毒的H2S气体逸出: (2)金属硫化物是以均匀沉淀的方式得到的,性质较好,共沉 淀减少,便于分离和洗涤: (3)使用方便。 七、定性分析实验报告格式 写好实验报告是实验的重要环节之一。做实验时应将观察到 的现象和推理等及时记在记录本上,不允许用单页纸记录或凭记
,可以代替( 沉淀第 组阳离 使 组与 组 分 煮沸则 在碱性溶液中水解生成 ,可以代替 离。水解反应如下: 在氨性溶液中水解生成 子。水解反应如下: 水解速率随溶液酸度、温度而异,温度高水解加快,一般在沸腾水 浴中进行。在碱性溶液中水解比在酸性溶液中更快。 可以减少有毒的 硫代乙酰胺作为组试剂的主要特点为: 气体逸出; 金属硫化物是以均匀沉淀的方式得到的,性质较好,共沉 淀减少,便于分离和洗涤; 使用方便。 七、定性分析实验报告格式 写好实验报告是实验的重要环节之一。做实验时应将观察到 的现象和推理等及时记在记录本上,不允许用单页纸记录或凭记 表 阳离子硫化氢系统分组方案
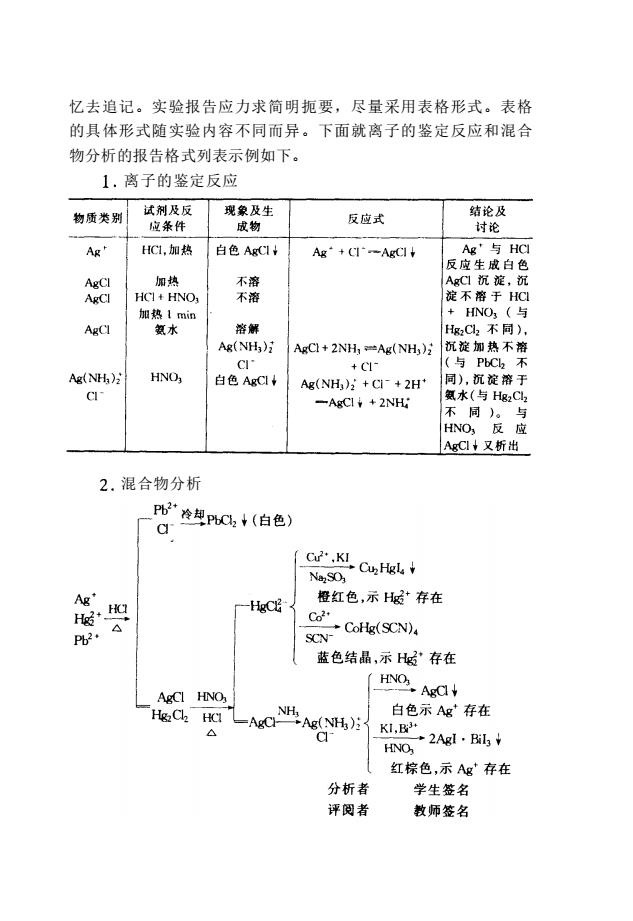
忆去追记。实验报告应力求简明扼要,尽量采用表格形式。表格 的具体形式随实验内容不同而异。下面就离子的鉴定反应和混合 物分析的报告格式列表示例如下。 1.离子的鉴定反应 物质类别 试剂及反 现象及生 应条件 反应式 结论及 成物 讨论 Ag" HCL,加热 白色AgCI+ Ag+CI-AgCl Ag'与HC 后 AgCI 加热 不溶 AgCI HCI+HNO 不餐 加热1min HNO; (与 AgCl 氨水 溶解 HgC,不同) Ag(NH3) AgCl+2NH,Ag(NH,) 沉淀加热不溶 CI (与PbC不 Ag(NH) HNO 白色AgCI Ag(NH)+Cl-+2H 同),沉淀溶于 CU -AgCI¥+2NH 氨水(与Hg2C 不周) AgC+又析出 2.混合物分析 _P吧冷却C2+(白色) a (c,KICu,Hgl.+ Ne2SO: Ag' 橙红色,示存在 HgC Co △ -CoHg(SCN) Pb2· SCN- 蓝色结晶,示”存在 AgCI HNO (HNOAC N 白色示Ag存在 △ AeSHK2Ae-, HNO 红棕色,示Ag存在 分析者 学牛答名 评阅者 教师签名
忆去追记。实验报告应力求简明扼要,尽量采用表格形式。表格 的具体形式随实验内容不同而异。下面就离子的鉴定反应和混合 物分析的报告格式列表示例如下。 离子的鉴定反应 混合物分析