
实验三凝胶检测和等位基因型鉴别一、实验目的1、掌握电泳的基本原理和方法2、比较两种电泳方式的异同二、实验原理琼脂糖或聚丙烯酰胺凝胶电泳都是分子克隆的核心技术之一,它用于分离、鉴定和纯化DNA片断。后者最适合分离小片段DNA(5bp~500bp),它的分辨率非常高,长度上相差1bp或质量上相差0.1%的DNA都能可以彼此分离。前者较后者分辨率低,但分离范围大,50bp到百万bp长的DNA都可以在不同浓度和构型的凝胶中分离。(一)琼脂糖凝胶琼脂糖是D-半乳糖残基通过α(1→3)和β(1-→4)糖苷键交替构成的线状聚合物。L-半乳糖残基在3和6位之间形成脱水连接。琼脂糖键形成螺旋纤维,后者再聚合成半径20~30nm的超螺旋结构。琼脂糖凝胶可以构成一个直径从50nm到略大于200mm的三维筛孔的通道。在琼脂糖凝胶中DNA的迁移速率受到以下几个因素的影响:1.DNA分子的大小双链DNA分子在凝胶基质迁移的速率与其碱基对数的常用对数成反比。分子越大,迁移得越慢,因为摩擦阻力越大,也因为大分子通过凝胶孔径的效率低于较小的分子。2.琼脂糖浓度凝胶的浓度和DNA电泳迁移率之间存在线性相关,可表述为:Igu =lgμo-KrtHo:DNA自由电泳迁移率;Kr:阻滞系数,是一个与凝胶性质、迁移分子大小和性状相关的常数。3.DNA的构象超螺旋环状(I)、切口环形(II)和线状(II)DNA的相对迁移率主要取决于琼脂糖凝胶的浓度和类型。在一些情况下,I型比Ⅲ型迁移得更快:绝大多数情况下,区分不同构象DNA的需求都很简单,主要是区分未处理的环状DNA样品和单一位点经限制酶作用线状化的同一DNA样品。4.凝胶和电泳缓冲液中的溴化乙锭溴化乙锭(EB)插入双链DNA造成负电荷减少,而刚性和长度增加。5.电泳电压低电压时,DNA片断迁移率与所用的电压成正比,但是电场强度升高时,高分子质量片断的迁移率遂不成比例增加。6.琼脂糖种类常见的有两种:标准琼脂糖和低熔点琼脂糖。7.电泳缓冲液当电泳缓冲液中缺乏离子则电导率降至很低,DNA迁移极慢;高离子强度时,电导率升高,即使使用适中的电压也会产生大量的热能,严重时凝胶会熔化,DNA变性。(二)聚丙烯酰胺垂直电泳
实验三 凝胶检测和等位基因型鉴别 一、实验目的 1、掌握电泳的基本原理和方法 2、比较两种电泳方式的异同 二、实验原理 琼脂糖或聚丙烯酰胺凝胶电泳都是分子克隆的核心技术之一,它用于分离、鉴定和纯化 DNA 片断。后者最适合分离小片段 DNA(5bp~500bp),它的分辨率非常高,长度上相差 1bp 或质量上相差 0.1%的 DNA 都能可以彼此分离。前者较后者分辨率低,但分离范围大, 50bp 到百万 bp 长的 DNA 都可以在不同浓度和构型的凝胶中分离。 (一)琼脂糖凝胶 琼脂糖是 D-半乳糖残基通过α(1→3)和β(1→4)糖苷键交替构成的线状聚合物。 L-半乳糖残基在 3 和 6 位之间形成脱水连接。琼脂糖键形成螺旋纤维,后者再聚合成半径 20~30nm 的超螺旋结构。琼脂糖凝胶可以构成一个直径从 50nm 到略大于 200nm 的三维筛 孔的通道。 在琼脂糖凝胶中 DNA 的迁移速率受到以下几个因素的影响: ⒈ DNA 分子的大小 双链 DNA 分子在凝胶基质迁移的速率与其碱基对数的常用对数 成反比。分子越大,迁移得越慢,因为摩擦阻力越大,也因为大分子通过凝胶孔径 的效率低于较小的分子。 ⒉ 琼脂糖浓度 凝胶的浓度和 DNA 电泳迁移率之间存在线性相关,可表述为: lgµ =lgµ0—Krt µ0:DNA 自由电泳迁移率;Kr:阻滞系数,是一个与凝胶性质、迁移分子大小和 性状相关的常数。 ⒊ DNA 的构象 超螺旋环状(Ⅰ)、切口环形(Ⅱ)和线状(Ⅲ)DNA 的相对迁移率 主要取决于琼脂糖凝胶的浓度和类型。在一些情况下,Ⅰ型比Ⅲ型迁移得更快;绝 大多数情况下,区分不同构象 DNA 的需求都很简单,主要是区分未处理的环状 DNA 样品和单一位点经限制酶作用线状化的同一 DNA 样品。 ⒋ 凝胶和电泳缓冲液中的溴化乙锭 溴化乙锭(EB)插入双链 DNA 造成负电荷减少,而 刚性和长度增加。 ⒌ 电泳电压 低电压时,DNA 片断迁移率与所用的电压成正比,但是电场强度升高时, 高分子质量片断的迁移率遂不成比例增加。 ⒍ 琼脂糖种类 常见的有两种:标准琼脂糖和低熔点琼脂糖。 ⒎ 电泳缓冲液 当电泳缓冲液中缺乏离子则电导率降至很低,DNA 迁移极慢;高离子 强度时,电导率升高,即使使用适中的电压也会产生大量的热能,严重时凝胶会熔 化,DNA 变性。 (二)聚丙烯酰胺垂直电泳
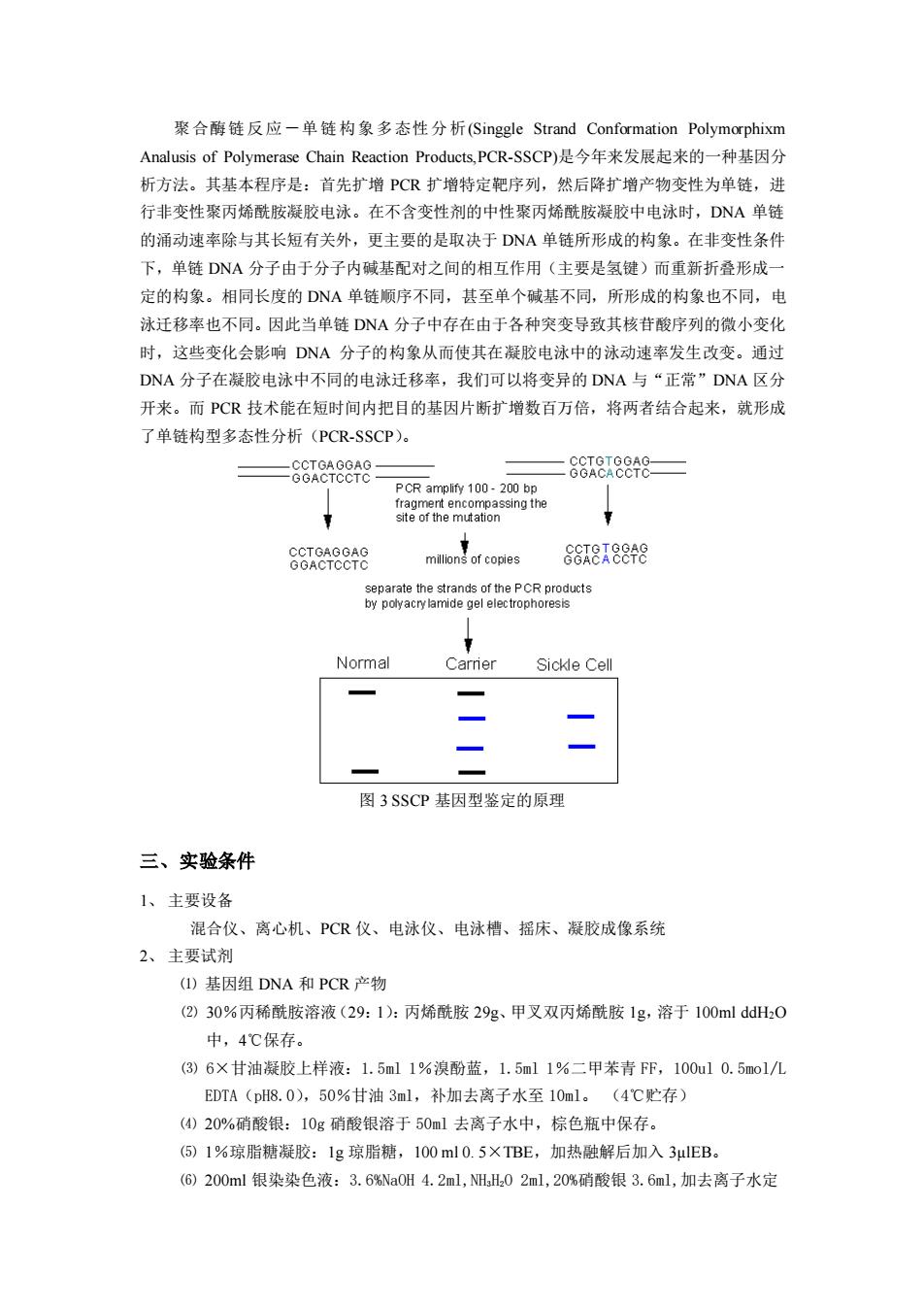
聚合酶链反应一单链构象多态性分析(SinggleStrandConformationPolymorphixmAnalusisofPolymeraseChainReactionProducts,PCR-SSCP)是今年来发展起来的一种基因分析方法。其基本程序是:首先扩增PCR扩增特定靶序列,然后降扩增产物变性为单链,进行非变性聚丙烯酰胺凝胶电泳。在不含变性剂的中性聚丙烯酰胺凝胶中电泳时,DNA单链的涌动速率除与其长短有关外,更主要的是取决于DNA单链所形成的构象。在非变性条件下,单链DNA分子由于分子内碱基配对之间的相互作用(主要是氢键)而重新折叠形成一定的构象。相同长度的DNA单链顺序不同,甚至单个碱基不同,所形成的构象也不同,电泳迁移率也不同。因此当单链DNA分子中存在由于各种突变导致其核苷酸序列的微小变化时,这些变化会影响DNA分子的构象从而使其在凝胶电泳中的泳动速率发生改变。通过DNA分子在凝胶电泳中不同的电泳迁移率,我们可以将变异的DNA与“正常”DNA区分开来。而PCR技术能在短时间内把目的基因片断扩增数百万倍,将两者结合起来,就形成了单链构型多态性分析(PCR-SSCP)。CCTGTGGAGCCTGAGGAGGGACACCTOGGACTCCTCPCRamplify100-200bpfragmentencompassingtheTTsite of the mutationCCTGAGGAGGOTCTCCREmillions of copiesGGACTCCTCseparatethestrands ofthePCRproductsbypolyacrylamidegelelectrophoresis7NormalCarrierSickle Cell图3SSCP基因型鉴定的原理三、实验条件1、主要设备混合仪、离心机、PCR仪、电泳仪、电泳槽、摇床、凝胶成像系统2、主要试剂(1)基因组DNA和PCR产物(2)30%丙稀酰胺溶液(29:1):丙烯酰胺29g、甲叉双丙烯酰胺1g,溶于100mlddH20中,4℃保存。(3)6×甘油凝胶上样液:1.5ml1%溴酚蓝,1.5ml1%二甲苯青FF,100ul0.5mo1/LEDTA(pH8.0),50%甘油3ml,补加去离子水至10ml。(4℃贮存)(4)20%硝酸银:10g硝酸银溶于50ml去离子水中,棕色瓶中保存。(5)1%琼脂糖凝胶:1g琼脂糖,100ml0.5XTBE,加热融解后加入3ulEB。(6)200ml银染染色液:3.6%Na0H4.2ml,NH.H202ml,20%硝酸银3.6ml,加去离子水定
聚合酶链反应-单链构象多态性分析(Singgle Strand Conformation Polymorphixm Analusis of Polymerase Chain Reaction Products,PCR-SSCP)是今年来发展起来的一种基因分 析方法。其基本程序是:首先扩增 PCR 扩增特定靶序列,然后降扩增产物变性为单链,进 行非变性聚丙烯酰胺凝胶电泳。在不含变性剂的中性聚丙烯酰胺凝胶中电泳时,DNA 单链 的涌动速率除与其长短有关外,更主要的是取决于 DNA 单链所形成的构象。在非变性条件 下,单链 DNA 分子由于分子内碱基配对之间的相互作用(主要是氢键)而重新折叠形成一 定的构象。相同长度的 DNA 单链顺序不同,甚至单个碱基不同,所形成的构象也不同,电 泳迁移率也不同。因此当单链 DNA 分子中存在由于各种突变导致其核苷酸序列的微小变化 时,这些变化会影响 DNA 分子的构象从而使其在凝胶电泳中的泳动速率发生改变。通过 DNA 分子在凝胶电泳中不同的电泳迁移率,我们可以将变异的 DNA 与“正常”DNA 区分 开来。而 PCR 技术能在短时间内把目的基因片断扩增数百万倍,将两者结合起来,就形成 了单链构型多态性分析(PCR-SSCP)。 图 3 SSCP 基因型鉴定的原理 三、实验条件 1、 主要设备 混合仪、离心机、PCR 仪、电泳仪、电泳槽、摇床、凝胶成像系统 2、 主要试剂 ⑴ 基因组 DNA 和 PCR 产物 ⑵ 30%丙稀酰胺溶液(29:1):丙烯酰胺 29g、甲叉双丙烯酰胺 1g,溶于 100ml ddH2O 中,4℃保存。 ⑶ 6×甘油凝胶上样液:1.5ml 1%溴酚蓝,1.5ml 1%二甲苯青 FF,100ul 0.5mol/L EDTA(pH8.0),50%甘油 3ml,补加去离子水至 10ml。 (4℃贮存) ⑷ 20%硝酸银:10g 硝酸银溶于 50ml 去离子水中,棕色瓶中保存。 ⑸ 1%琼脂糖凝胶:1g 琼脂糖,100 ml 0. 5×TBE,加热融解后加入 3µlEB。 ⑹ 200ml 银染染色液:3.6%NaOH 4.2ml,NH3H2O 2ml,20%硝酸银 3.6ml,加去离子水定

容至200ml,现配现用。(7)10XTBE缓冲液:Tris碱108g,硼酸55g,0.5mo1/LEDTA(pH8.0)40ml,加水至1L。(8)10%过硫酸铵:把1g过硫酸铵溶解于终量为10ml的水溶液中,该溶液可在4℃保存数周。(9)8%大板胶:30%PAGE8ml,10×TBE3ml,50%甘油16ml,双蒸水16mlAPS200210ul,TEMED12l。(10)200ml染色液:甲醛100川l,1%柠檬酸钠1ml,加ddH20定容至200ml,现配现用。(D)分子量标记:MarkerDL2000(2)TEMEDN.N.NN一四甲基乙二胺)(13)70%乙醇:70ml无水乙醇溶于30ml去离子水中,混匀。(14)1%溴酚蓝:加1g水溶性钠型溴酚蓝于100ml水中,搅拌或涡旋混合直到完全溶解。(15)1%二甲苯青FF溶解1g二甲苯青FF于足量水中,定容到100ml。(16)10mg/ml溴化乙锭:小心称取1g溴化乙锭,转移到广口瓶中,加100ml水,用磁力搅拌器搅拌直到完全溶解。用铝箔包裹装液管,于4℃贮存。四、实验方法和步骤(一)琼脂糖凝胶检测基因组DNA1.先用自来水清洗凝胶支持板和凝胶槽及梳子,后用去离子水冲洗,自然风干。2.将凝胶支持板放入到凝胶槽内,梳子卡在凝胶槽上,然后放在一个水平的位置上。3.在微波炉内或电炉上加热1%琼脂糖凝胶使其充分的熔化,冷却至40℃(手感觉不烫)时加入1/1000体积的EB,使终浓度为0.5μg/ml,混匀,将熔化的胶液缓慢倒入到凝胶支持板中,使液面刚好不溢出凝胶支持板,赶走所有的气泡,室温下使胶自然冷却完全凝固。4.缓慢地在垂直方向向上拔下梳子,去处掉凝胶支持板四周的多余的胶体,然后将胶板和凝胶支持板一起安放在电泳槽内,向电泳槽内加入电泳缓冲液刚好没过凝胶1mm。同时设定电泳仪电压120V,电流65mA,并预电泳10min。5.取2一3ul“实验一”提取的基因组DNA样品和0.2倍体积的LoadingBuffer(具体浓度视Marker而不同)混和。用微量移液器在胶孔中从左到右依次小心加入Marker和各基因组DNA样品。6.接通电源,给予5V/cm的电压,此时在阳极和阴极之间由于电解作用产生气泡,并且几分钟后溴酚蓝从加样孔迁移进入胶体内。7.当DNA样品或染料在凝胶中迁移一半位置时,关掉电源,取出,沥尽电泳液。8.将胶板放在凝胶成像系统下,拿出凝胶支持板,照射拍照保存。9.拍照完毕从凝胶成像系统下取出凝胶,放入指定位置,清理干净凝胶成像系统。(二)聚合酶链反应一单链构象多态性分析基因型1.电泳槽玻璃板的处理:用洗涤剂清洗玻璃板,自来水反复冲洗洗涤剂,双蒸水冲洗3次,晾干,95%乙醇擦拭,自然风干。在两块玻璃板内的两侧放好衬条,用固定
容至 200ml,现配现用。 ⑺ 10×TBE 缓冲液:Tris 碱 108g,硼酸 55g,0.5mol/L EDTA(pH8.0)40ml,加水至 1L。 ⑻ 10%过硫酸铵:把 1g 过硫酸铵溶解于终量为 10ml 的水溶液中,该溶液可在 4℃保 存数周。 ⑼ 8%大板胶:30%PAGE 8ml,10×TBE 3ml,50%甘油 16ml,双蒸水 16ml, APS 200- 210µl, TEMED 12µl。 ⑽ 200ml 染色液:甲醛 100µl,1%柠檬酸钠 1ml,加 ddH2O 定容至 200ml,现配现用。 ⑾ 分子量标记:Marker DL 2000 ⑿ TEMED(N,N,N,N’-四甲基乙二胺) ⒀ 70%乙醇:70ml 无水乙醇溶于 30ml 去离子水中,混匀。 ⒁ 1%溴酚蓝:加 1g 水溶性钠型溴酚蓝于 100ml 水中,搅拌或涡旋混合直到完全溶 解。 ⒂ 1%二甲苯青 FF 溶解 1g 二甲苯青 FF 于足量水中,定容到 100ml。 ⒃ 10mg/ml 溴化乙锭:小心称取 1g 溴化乙锭,转移到广口瓶中,加 100ml 水,用磁 力搅拌器搅拌直到完全溶解。用铝箔包裹装液管,于 4℃贮存。 四、实验方法和步骤 (一)琼脂糖凝胶检测基因组 DNA ⒈ 先用自来水清洗凝胶支持板和凝胶槽及梳子,后用去离子水冲洗,自然风干。 ⒉ 将凝胶支持板放入到凝胶槽内,梳子卡在凝胶槽上,然后放在一个水平的位置上。 ⒊ 在微波炉内或电炉上加热 1%琼脂糖凝胶使其充分的熔化,冷却至 40℃(手感觉不 烫)时加入 1/1000 体积的 EB,使终浓度为 0.5µg/ml,混匀,将熔化的胶液缓慢倒 入到凝胶支持板中,使液面刚好不溢出凝胶支持板,赶走所有的气泡,室温下使胶 自然冷却完全凝固。 ⒋ 缓慢地在垂直方向向上拔下梳子,去处掉凝胶支持板四周的多余的胶体,然后将 胶板和凝胶支持板一起安放在电泳槽内,向电泳槽内加入电泳缓冲液刚好没过凝胶 1mm。同时设定电泳仪电压 120V,电流 65mA,并预电泳 10min。 ⒌ 取 2-3µl“实验 一”提取的基因组 DNA 样品和 0.2 倍体积的 Loading Buffer(具体 浓度视 Marker 而不同)混和。用微量移液器在胶孔中从左到右依次小心加入 Marker 和各基因组 DNA 样品。 ⒍ 接通电源,给予 5V/cm 的电压,此时在阳极和阴极之间由于电解作用产生气泡,并 且几分钟后溴酚蓝从加样孔迁移进入胶体内。 ⒎ 当 DNA 样品或染料在凝胶中迁移一半位置时,关掉电源,取出,沥尽电泳液。 ⒏ 将胶板放在凝胶成像系统下,拿出凝胶支持板,照射拍照保存。 ⒐ 拍照完毕从凝胶成像系统下取出凝胶,放入指定位置,清理干净凝胶成像系统。 (二)聚合酶链反应-单链构象多态性分析基因型 ⒈ 电泳槽玻璃板的处理:用洗涤剂清洗玻璃板,自来水反复冲洗洗涤剂,双蒸水冲洗 3 次,晾干,95%乙醇擦拭,自然风干。在两块玻璃板内的两侧放好衬条,用固定

夹夹紧两块玻璃,并用玻璃胶带封边。2.配胶:按照被分离DNA片断的大小、含量及玻璃板、衬条的大小决定凝胶的浓度与体积,一般来讲使用5%一8%的凝胶较为合适。在100ml小烧杯中加入30%丙烯酰胺8ml,10×TBE3ml,去离子水12.8ml,50%甘油16ml,10%过硫酸铵0.4mlTEMED12μl,轻轻摇匀。迅速用玻璃杯紧贴玻璃板表面,将玻璃模具倾斜45°,缓慢注入两玻璃板间的空隙中,直至灌满模具顶部。立即插入相应的点样梳(小心勿使梳齿下带进气泡,并且不要将梳齿全部插入胶内,留约2mm梳齿于玻璃板上端,以免拔梳齿时把胶孔拔断)。由于凝胶在聚合过程中有回缩,所以要小心添加些胶液于梳子处,水平放置,室温聚合约1h。将封口玻璃胶带揭去,放入电泳槽,凹型玻璃贴紧电泳缓冲液槽,用大号固定夹夹固定。在上下电泳槽内注入1XTBE电泳缓冲液。小心取出点样梳,用槽内的缓冲液反复冲洗点样孔,以去处气泡和可能存在的未聚合的丙烯酰胺。3.扩增产物的处理:取PCR扩增产物0.5ul与变性上样液按9.5ul加入到0.5ml微量离心管中,混匀。样品上胶前应95℃变性10min,立即冰浴骤冷。再用微量移液器上样变性样品(根据点样孔的大小决定上样量,上样时要注意不要有气泡冲散样品,而且速度要快,时间长了样品易于扩散)。4.电泳:电泳槽接上电极,开启电源,根据扩增片断的大小及电泳槽和凝胶的大小,决定电泳的电压及电泳时间,通常室温下1~5V/cm电泳。5.剥胶:电泳结束后,倒弃电泳缓冲液,取下电泳胶玻璃,用塑料楔子从玻璃板底部一角小心分开玻璃,凝胶应附着再一块玻璃上,切去凝胶左上角,作为点样顺序标记,另外要切去其它多余部分。用胶条小心将凝胶拨到已经清洗好的瓷盘中。6.银染:再瓷盘中注入适量70%的乙醇,摇床上缓慢固定1015min(乙醇用完可以回收利用2一3次)→去离子水洗胶两边,每次2min(洗去乙醇)→用200ml染色液染色30min→去离子水洗胶三遍,每次2min(洗去多余染色液)→200ml显色液约10~30min,当DNA带强度合适时去掉显色液→去离子水冲洗多余显色液,保鲜膜封存,拍照,保存。五、注意事项(一)琼脂糖凝胶检测基因组DNA1.在配制琼脂糖凝胶时,EB要在琼脂糖完全融解于TBE溶液而且冷却后未聚合前加入,否则剧毒性的EB会挥发。2.在向凝胶模具中注入熔化的琼脂糖时,温度不可太高,以免烫坏点样梳。3.注入琼脂糖凝胶时,胶液面要稍稍低于凝胶支持板的边框,因为胶液在聚合时要收缩液面下降。4.当点样数过多时,Marker2000可以点在胶板的中央,利于比对。5.混和载样缓冲液和样品基因组DNA时,基因组DNA上样量不可过多,样品量过多有时分离效果也不好,另外也浪费样品。6.电泳时电压和电流不要太高求高求快,电压电流高,相应的电泳液和胶体温度也高
夹夹紧两块玻璃,并用玻璃胶带封边。 ⒉ 配胶:按照被分离 DNA 片断的大小、含量及玻璃板、衬条的大小决定凝胶的浓度 与体积,一般来讲使用 5%-8%的凝胶较为合适。在 100ml 小烧杯中加入 30%丙 烯酰胺 8ml, 10×TBE 3ml,去离子水 12.8ml,50%甘油 16ml,10%过硫酸铵 0.4ml TEMED12µl, 轻轻摇匀。迅速用玻璃杯紧贴玻璃板表面,将玻璃模具倾斜 45°,缓 慢注入两玻璃板间的空隙中,直至灌满模具顶部。立即插入相应的点样梳(小心勿 使梳齿下带进气泡,并且不要将梳齿全部插入胶内,留约 2mm 梳齿于玻璃板上端, 以免拔梳齿时把胶孔拔断)。由于凝胶在聚合过程中有回缩,所以要小心添加些胶液 于梳子处,水平放置,室温聚合约 1h。将封口玻璃胶带揭去,放入电泳槽,凹型玻 璃贴紧电泳缓冲液槽,用大号固定夹夹固定。在上下电泳槽内注入 1×TBE 电泳缓 冲液。小心取出点样梳,用槽内的缓冲液反复冲洗点样孔,以去处气泡和可能存在 的未聚合的丙烯酰胺。 ⒊ 扩增产物的处理: 取 PCR 扩增产物 0.5µl 与变性上样液按 9.5µl 加入到 0.5ml 微量 离心管中,混匀。样品上胶前应 95℃变性 10min,立即冰浴骤冷。再用微量移液器 上样变性样品(根据点样孔的大小决定上样量,上样时要注意不要有气泡冲散样品, 而且速度要快,时间长了样品易于扩散)。 ⒋ 电泳:电泳槽接上电极,开启电源,根据扩增片断的大小及电泳槽和凝胶的大小, 决定电泳的电压及电泳时间,通常室温下 1~5V/cm 电泳。 ⒌ 剥胶:电泳结束后,倒弃电泳缓冲液,取下电泳胶玻璃,用塑料楔子从玻璃板底部 一角小心分开玻璃,凝胶应附着再一块玻璃上,切去凝胶左上角,作为点样顺序标 记,另外要切去其它多余部分。用胶条小心将凝胶拨到已经清洗好的瓷盘中。 ⒍ 银染:再瓷盘中注入适量 70%的乙醇,摇床上缓慢固定 10~15min(乙醇用完可以 回收利用 2-3 次)→去离子水洗胶两边,每次 2min(洗去乙醇)→用 200ml 染色 液染色 30min→去离子水洗胶三遍,每次 2min(洗去多余染色液)→200ml 显色液 约 10~30min,当 DNA 带强度合适时去掉显色液→去离子水冲洗多余显色液,保鲜 膜封存,拍照,保存。 五、注意事项 (一)琼脂糖凝胶检测基因组 DNA ⒈ 在配制琼脂糖凝胶时,EB要在琼脂糖完全融解于TBE 溶液而且冷却后未聚合前加入, 否则剧毒性的 EB 会挥发。 ⒉ 在向凝胶模具中注入熔化的琼脂糖时,温度不可太高,以免烫坏点样梳。 ⒊ 注入琼脂糖凝胶时,胶液面要稍稍低于凝胶支持板的边框,因为胶液在聚合时要收缩, 液面下降。 ⒋ 当点样数过多时,Marker2000 可以点在胶板的中央,利于比对。 ⒌ 混和载样缓冲液和样品基因组 DNA 时,基因组 DNA 上样量不可过多,样品量过多 有时分离效果也不好,另外也浪费样品。 ⒍ 电泳时电压和电流不要太高求高求快,电压电流高,相应的电泳液和胶体温度也高

电泳液由于蒸发离子浓度会变大,胶板也有可能熔化,影响电泳效果。7.成像结束后,清理凝胶成像系统中的胶板,以保证设备的正常运行。(二)聚合酶链反应一单链构象多态性分析基因型1.核酸片段的大小:核酸片段越小,检测的灵敏度越高。对于<200bp的片段,SSCP可发现70%的变异;对于300bp左右的片段只能发现50%的变异;>500bp的片段,仅能检测10~30%的变异,因此,150bp左右的核酸片段更适于SSCP分析。大的片段可以通过限制性酶切进一步处理。2.游离引物:游离引物可能同PCR产物结合而改变其泳动率,即使游离引物为6nM都有明显影响,因此,尽可能除去游离引物,可通过不对称引物扩增法或过柱或磁性球方法纯化PCR产物。3.电泳温度:一般认为保持凝胶内温度恒定时SSCP分析最关键的因素,温度有可能直接影响DNA分子内部稳定力的形成及其所界定的单链构象,从而影响突变的检出。室温下电泳适于大多数情况,但由于在电泳时温度会升高,为确保电泳温度相对恒定应采取以下措施:减少凝胶厚度,降低电压,有效的空气冷却或循环水冷却等4.凝胶的长度:可用测序板进行SSCP分析,凝胶板长度在40cm以上。5.凝胶浓度及厚度:凝胶浓度很重要,一般使用58%的凝胶,凝胶浓度不同,突变点的相对位置也不同,如果在进行未知突变种类的SSCP分析时,最好采用两种以上的凝胶浓度,这样可以提高突变中列的检出率。凝胶的厚度对SSCP分析也很重要,凝胶越厚,背景越深。6.假阴性:一般认为,如没有污染,PCR-SSCP分析不存在假阳性结果,但可能出现假阴性结果,后者是由于点突变引起的空间构象变化甚微,迁移率相差无几所致,尤其是点突变发生在扩增片断的两端。如果有阳性和阴性对照,结果可以重复确定的突变带是可信的,如果没有阳性对照,应测序来确定其是否为突变带。也可通过设置阳性对照,模索电泳条件,很大程度消除假阴性结果。7.在配制胶溶液和制胶的过程中,要戴手套,因为丙烯酰胺经皮肤吸收,有强烈神经毒素,在称取粉末时,注意呼吸道吸入。图4SSCP方法鉴定的TYR基因某位点基因型六、思考题1、试分析EB染色和银离子染色的效果和注意事项的异同。2、杂合基因在琼脂糖胶和SSCP胶电泳后的带型有何不同。七、实验报告根据自己所在小组的实验操作,做一份实验报告,结合胶图说明实验结果,区分不同的基因型,并写下实验中的心得体会
电泳液由于蒸发离子浓度会变大,胶板也有可能熔化,影响电泳效果。 ⒎ 成像结束后,清理凝胶成像系统中的胶板,以保证设备的正常运行。 (二)聚合酶链反应-单链构象多态性分析基因型 ⒈ 核酸片段的大小:核酸片段越小,检测的灵敏度越高。对于<200bp 的片段,SSCP 可 发现 70%的变异;对于 300bp 左右的片段只能发现 50%的变异;>500bp 的片段,仅 能检测 10~30%的变异,因此,150bp 左右的核酸片段更适于 SSCP 分析。大的片段 可以通过限制性酶切进一步处理。 ⒉ 游离引物:游离引物可能同 PCR 产物结合而改变其泳动率,即使游离引物为 6nM 都 有明显影响,因此,尽可能除去游离引物,可通过不对称引物扩增法或过柱或磁性球 方法纯化 PCR 产物。 ⒊ 电泳温度:一般认为保持凝胶内温度恒定时 SSCP 分析最关键的因素,温度有可能 直接影响 DNA 分子内部稳定力的形成及其所界定的单链构象,从而影响突变的检出。 室温下电泳适于大多数情况,但由于在电泳时温度会升高,为确保电泳温度相对恒定, 应采取以下措施:减少凝胶厚度,降低电压,有效的空气冷却或循环水冷却等。 ⒋ 凝胶的长度: 可用测序板进行 SSCP 分析,凝胶板长度在 40cm 以上。 ⒌ 凝胶浓度及厚度:凝胶浓度很重要,一般使用 5~8%的凝胶,凝胶浓度不同,突变 点的相对位置也不同,如果在进行未知突变种类的 SSCP 分析时,最好采用两种以上 的凝胶浓度,这样可以提高突变中列的检出率。凝胶的厚度对 SSCP 分析也很重要, 凝胶越厚,背景越深。 ⒍ 假阴性:一般认为,如没有污染,PCR-SSCP 分析不存在假阳性结果,但可能出现假 阴性结果,后者是由于点突变引起的空间构象变化甚微,迁移率相差无几所致,尤其 是点突变发生在扩增片断的两端。如果有阳性和阴性对照,结果可以重复确定的突变 带是可信的,如果没有阳性对照,应测序来确定其是否为突变带。也可通过设置阳性 对照,摸索电泳条件,很大程度消除假阴性结果。 ⒎ 在配制胶溶液和制胶的过程中,要戴手套,因为丙烯酰胺经皮肤吸收,有强烈神经毒 素,在称取粉末时,注意呼吸道吸入。 图 4 SSCP 方法鉴定的 TYR 基因某位点基因型 六、思考题 1、试分析 EB 染色和银离子染色的效果和注意事项的异同。 2、杂合基因在琼脂糖胶和 SSCP 胶电泳后的带型有何不同。 七、实验报告 根据自己所在小组的实验操作,做一份实验报告,结合胶图说明实验结果,区分不同的 基因型,并写下实验中的心得体会