
若在一个非基元反应中,有一步反应的速率最 慢,它能控制总反应的速率,总反应的速率基本上 等于这最慢一步的速率,则这最慢的一步反应就叫 速率控制步骤,简称速控步骤。 在基元反应中反应物微粒数之和称为反应分子 数(molecularity of reaction),不是反应方 程式中反应物的计量系数之和,它是需要同时碰撞 才能发生化学反应的微粒。 单分子反应,如:S02C12=S02+C2 基元反应 双分子反应,如:2N20(g)=2N2(g)+O2(g) 可分为 三分子反应,如:H2(g)+2I(g)=2Hl(g)
在基元反应中反应物微粒数之和称为反应分子 数(molecularity of reaction),不是反应方 程式中反应物的计量系数之和,它是需要同时碰撞 才能发生化学反应的微粒。 若在一个非基元反应中,有一步反应的速率最 慢,它能控制总反应的速率,总反应的速率基本上 等于这最慢一步的速率,则这最慢的一步反应就叫 速率控制步骤,简称速控步骤。 基元反应 可分为 单分子反应,如: 双分子反应,如:2N2O(g)= 2N2(g)+O2(g) 三分子反应,如: H2(g)+ 2I(g)= 2HI(g) SO2Cl2 =SO2+Cl2

§3.2 化学反应速率理论简介 碰撞理论:20世纪初路易斯(Lewis.) 气体分子运动论 过渡状态理论:20世纪30年代初艾林(Eyring) 量子力学和统计力学
§3.2 化学反应速率理论简介 碰撞理论:20世纪初路易斯(Lewis) 气体分子运动论 过渡状态理论:20世纪30年代初艾林(Eyring) 量子力学和统计力学

並撞理论 发生反应的碰撞,叫做有效碰撞 不发生反应的碰撞,叫做弹性碰撞 发生有效碰撞,反应物分子或离子必须具备的两个条件: (1) 需要有足够的能量: (2) 碰撞时要有合适的方向。如反应:
发生反应的碰撞,叫做有效碰撞 发生有效碰撞,反应物分子或离子必须具备的两个条件: (1)需要有足够的能量; (2)碰撞时要有合适的方向。如反应: 一、碰撞理论 不发生反应的碰撞,叫做弹性碰撞

NO(g)+O3=NO2(g)+02(g) % 。氧原子 。氮原子 O3与NO间的碰撞
NO(g) + O3 = NO2 (g) +O2 (g)
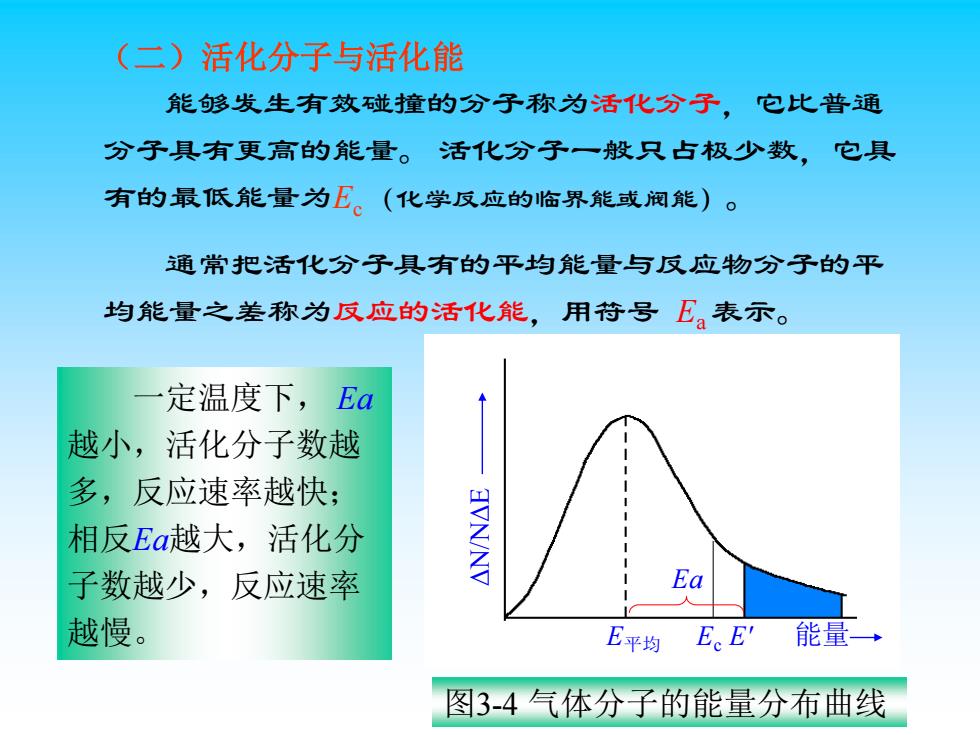
(二)活化分子与活化能 能够发生有效碰撞的分子称为活化分子,它比普通 分子具有更高的能量。活化分子一般只占极少数,它具 有的最低能量为E。(化学反应的临界能或阀能)。 通常把活化分子具有的平均能量与反应物分子的平 均能量之差称为反应的活化能,用苻号E。表示。 定温度下,Ea 越小,活化分子数越 多,反应速率越快; 相反Ea越大,活化分 子数越少,反应速率 Ea 越慢。 E平均 E。E'能量→ 图3-4气体分子的能量分布曲线
能够发生有效碰撞的分子称为活化分子,它比普通 分子具有更高的能量。 活化分子一般只占极少数,它具 有的最低能量为Ec (化学反应的临界能或阀能)。 通常把活化分子具有的平均能量与反应物分子的平 均能量之差称为反应的活化能,用符号 Ea 表示。 (二)活化分子与活化能 Ea E平均 E' 能量 图3-4 气体分子的能量分布曲线 一定温度下, Ea 越小,活化分子数越 多,反应速率越快; 相反Ea越大,活化分 子数越少,反应速率 越慢。 Ec