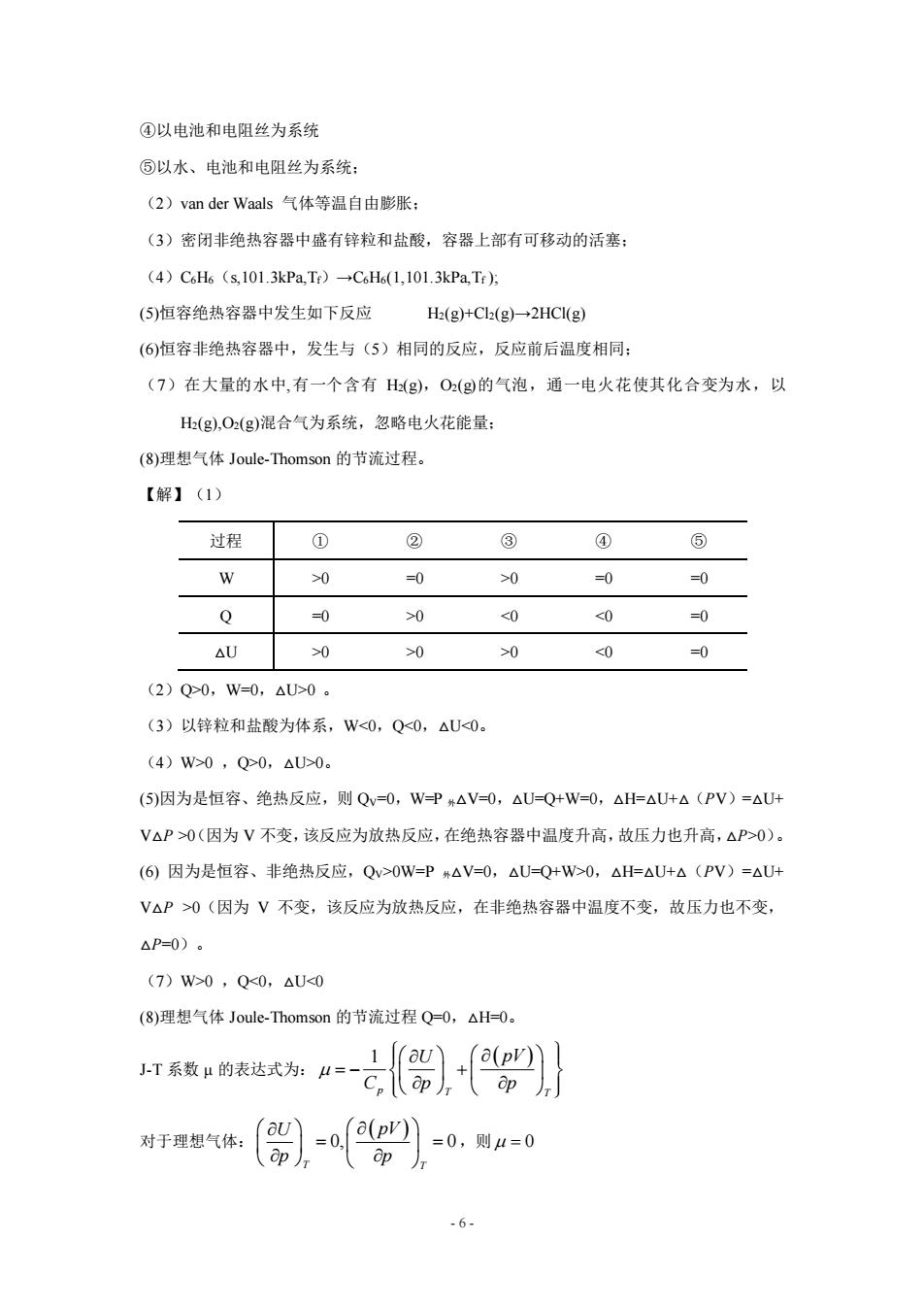
④以电池和电阻丝为系统 ⑤以水、电池和电阻丝为系统: (2)van der Waals气体等温自由膨胀: (3)密闭非绝热容器中盛有锌粒和盐酸,容器上部有可移动的活塞: (4)C6H6(s,101.3Pa,Tr)→C6H6(1,101.3kPa,Tf)方 (5)恒容绝热容器中发生如下反应 H(g)+C2(g)→2HCI(g) (6)恒容非绝热容器中,发生与(5)相同的反应,反应前后温度相同: (7)在大量的水中,有一个含有H(g),O2(g的气泡,通一电火花使其化合变为水,以 H(g),O2(g)混合气为系统,忽略电火花能量: (8)理想气体Joule--Thomson的节流过程。 【解】(1) 过程 ① ② ③ ④ ⑤ W 0 =0 >0 =0 =0 Q =0 >0 <0 <0 0 △U >0 >0 >0 <0 =0 (2)Q>0,W=0,△0U>0。 (3)以锌粒和盐酸为体系,W<0,Q<0,△U<0。 (4)W>0,Q>0,△U>0。 (5)因为是恒容、绝热反应,则Qv=0,W=P#△V=0,△U=Q+W=0,△H=△U+△(PV)=△U+ V△P>0(因为V不变,该反应为放热反应,在绝热容器中温度升高,故压力也升高,△P>0)。 (6)因为是恒容、非绝热反应,Qv>0W=P#△V=0,△U=Q+W>0,△H=△U+△(PV)=△U+ V△P>0(因为V不变,该反应为放热反应,在非绝热容器中温度不变,故压力也不变, △P=0)。 (7)W>0,Q<0,△U<0 (8)理想气体Joule-Thomson的节流过程Q=O,△H=0。 灯系数的表达式海A=七品)十四》 对于理想气体: -6
- 6 - ④以电池和电阻丝为系统 ⑤以水、电池和电阻丝为系统; (2)van der Waals 气体等温自由膨胀; (3)密闭非绝热容器中盛有锌粒和盐酸,容器上部有可移动的活塞; (4)C6H6(s,101.3kPa,Tf)→C6H6(1,101.3kPa,Tf ); (5)恒容绝热容器中发生如下反应 H2(g)+Cl2(g)→2HCl(g) (6)恒容非绝热容器中,发生与(5)相同的反应,反应前后温度相同; (7)在大量的水中,有一个含有 H2(g),O2(g)的气泡,通一电火花使其化合变为水,以 H2(g),O2(g)混合气为系统,忽略电火花能量; (8)理想气体 Joule-Thomson 的节流过程。 【解】(1) (2)Q>0,W=0,△U>0 。 (3)以锌粒和盐酸为体系,W<0,Q<0,△U<0。 (4)W>0 ,Q>0,△U>0。 (5)因为是恒容、绝热反应,则 QV=0,W=P 外△V=0,△U=Q+W=0,△H=△U+△(PV)=△U+ V△P >0(因为 V 不变,该反应为放热反应,在绝热容器中温度升高,故压力也升高,△P>0)。 (6) 因为是恒容、非绝热反应,QV>0W=P 外△V=0,△U=Q+W>0,△H=△U+△(PV)=△U+ V△P >0(因为 V 不变,该反应为放热反应,在非绝热容器中温度不变,故压力也不变, △P=0)。 (7)W>0 ,Q<0,△U<0 (8)理想气体 Joule-Thomson 的节流过程 Q=0,△H=0。 J-T 系数 μ 的表达式为: 1 ( ) p T T U pV C p p = − + 对于理想气体: ( ) 0, 0 T T U pV p p = = ,则 = 0 过程 ① ② ③ ④ ⑤ W >0 =0 >0 =0 =0 Q =0 >0 <0 <0 =0 △U >0 >0 >0 <0 =0

又因为4= OT 所以dT=0,理想气体的内能是温度的函数。 △U=0,W=△U-Q=0 【6】请列举4个不同类型的等焓过程。 例:(1)Joule-Thomson的节流过程:(2)理想气体的等温过程:(3)绝热等压反应(非 体积功为0)(4)理想气体的自由膨胀过程 【7】在下列关系式中,请指出哪几个是准确的,哪几个是不准确的,并简单说明理由。 (1)△.H(石墨,S)=△H(CO2.8) (2)△.H(H2,g)=△HR(HO,g) (3)△.HR(N2,g)=△H(2NO2g), (4)△.H(SO2,8)=0, (5)△rH(H2O,g)=△,H(H2O,1)+△mH(H2O,1) (6)△.H(02,g)=△H(H2O,1)。 解(1)准确,因为碳的最稳定单质是石墨固体,而1摩尔石墨完全燃烧生成1摩尔二氧 化碳气体。 (2)不准确,因为氢气完全燃烧的指定产物是液态的水,而不是气态的水。 (3)不准确,根据反应N2+2O,=2NO,的计量系数,可得: A.HN2,g)=2△H(NO2.g),而不是△.HN2,g)=△yH(2NO2.g) (4)不准确,因为SO,还可以燃烧生成SO,所以△.H(SO2,g)≠0。 (5)准确,根据下列变化可得△H但2O,g)=△,H(H2O,)+△pH(H2O,) H2g+0.5020)△rH8(H20g) H20(g) △fH品(H2O,D H2o0△vapm(H20,0 (6)不准确,因为△.H(H2,g)=△H(HO,1),而不是△.H(02,g)=△H(H2O,) 【8】Cpm是否恒大于Cvm?有一个化学反应,所有的气体都可以作为理想气体处理,若 反应的△Cpm>0,则反应的△Cvm也一定大于零吗? -7-
- 7 - 又因为 H T p = 所以 dT = 0 ,理想气体的内能是温度的函数。 △U=0,W=△U-Q=0 【6】请列举 4 个不同类型的等焓过程。 例:(1)Joule-Thomson 的节流过程;(2)理想气体的等温过程;(3)绝热等压反应(非 体积功为 0)(4)理想气体的自由膨胀过程 【7】在下列关系式中,请指出哪几个是准确的,哪几个是不准确的,并简单说明理由。 (1) 2, ( , ) ( ) c m f m H s H CO g = 石墨 , (2) 2 ( , ) ( , ) c m f m H g H H O g = 2 H , (3) 2, ( , ) (2 ) c m f m H g H NO g = 2 N , (4) 2 ( , ) 0 c m H SO g = , (5) 2 2 ( , ) ( ,1) ( ,1) f m f m vap m H O g H H O H H O = + 2 H , (6) 2 ( , ) ( ,1) c m f m H g H H O = 2 O 。 解 (1)准确,因为碳的最稳定单质是石墨固体,而 1 摩尔石墨完全燃烧生成 1 摩尔二氧 化碳气体。 (2) 不准确,因为氢气完全燃烧的指定产物是液态的水,而不是气态的水。 (3) 不准确,根据反应 2 2 N2 + = 2 2 O NO 的计量系数,可得: 2, ( , ) 2 ( ) c m f m H g H NO g = 2 N ,而不是 2, ( , ) (2 ) c m f m H g H NO g = 2 N (4) 不准确,因为 2 SO 还可以燃烧生成 3 SO ,所以 2 ( , ) 0 c m H SO g 。 (5) 准确,根据下列变化可得 2 2 ( , ) ( ,1) ( ,1) c m f m vap m H O g H H O H H O = + 2 H H2(g)+0.5O2(g) H2O(g) H2O(l) f Hm (H2O,g) fHm (H2O,l) Hm(H2O,l) vap (6) 不准确,因为 2 ( , ) ( ,1) c m f m H g H H O = 2 H ,而不是 2 ( , ) ( ,1) c m f m H g H H O = 2 O 【8】Cp,m是否恒大于 Cv,m?有一个化学反应,所有的气体都可以作为理想气体处理,若 反应的△Cp,m>0,则反应的△Cv,m也一定大于零吗?

【解】(1)Cpm不一定恒大于Cvm。气体的Cpm和Cvm的关系为: m 上式的物理意义如下: 恒容时体系的体积不变,而恒压时体系的体积随温度的升高要发生变化。 av (1)p 项表示,当体系体积变化时外界所提供的额外能量: aT 项表示,由于体系的体积增大,使分子间的距离增大,位能增大,使 热力学能增大所需的能量: aU 由于p和 m 都为正值,所以Cpm与C,m的差值的正负就取决于 m 项。如果体 av 系的体积随温度的升高而增大, 则 m 0,则Cpm>Cm:反之, 体系的体积随温 度的升高而缩小的话 aT <0,则Cpm<C,m· 通常情况下,大多数流体(气体和液体)的 >0:只有少数流体在某些温度范围内 aT <0,如水在0~4℃的范围内,随温度升高体积是减小的,所以Cm<Cvm。 对于理想气体,则有Cpm一Cvm=R。 (2)对于气体都可以作为理想气体处理的化学反应,则有△C,m=ACm十∑yR 即△C=aC,n一∑R 所以,若反应的△Cpm>0,反应的△Cvm不一定大于零。 -8-
- 8 - 【解】(1)Cp,m不一定恒大于 Cv,m。气体的 Cp,m和 Cv,m的关系为: m m p, , m p p m V m T U V C C V T = + - 上式的物理意义如下: 恒容时体系的体积不变,而恒压时体系的体积随温度的升高要发生变化。 (1) m p p V T 项表示,当体系体积变化时外界所提供的额外能量; (2) m m m T p U V V T 项表示,由于体系的体积增大,使分子间的距离增大,位能增大,使 热力学能增大所需的能量; 由于 p 和 m m T U V 都为正值,所以 Cp,m 与 CV m, 的差值的正负就取决于 m p V T 项。如果体 系的体积随温度的升高而增大,则 m p 0 V T ,则 C C p, , m V m ;反之,体系的体积随温 度的升高而缩小的话, m p 0 V T ,则 C C p, , m V m。 通常情况下,大多数流体(气体和液体)的 m p 0 V T ;只有少数流体在某些温度范围内 m p 0 V T ,如水在 0~4℃的范围内,随温度升高体积是减小的,所以 C C p, , m V m 。 对于理想气体,则有 C C R p, , m V m - = 。 (2)对于气体都可以作为理想气体处理的化学反应,则有 C C R p, , m V m B B = + 即 C C R V m m , p, B B = - 所以,若反应的△Cp,m>0, 反应的△Cv,m不一定大于零

习题解答 【1】如果一个系统从环境吸收了40J的热,而系统的热力学能却增加了200,问系统 从环境得到了多少功?如果该系统在膨胀过程中对环境作了10kJ的功,同时吸收了28k的 热,求系统的热力学能变化值。 【解】 W=△U-O=200J-40J=160J AU=Q+W=28kJ+(-10kJ)=18kJ 【2】有10mol的气体(设为理想气体),压力为1000kPa,温度为300K,分别求出温 度时下列过程的功: (1)在空气压力为100kPa时,体积胀大1dm3: (2)在空气压力为100kPa时,膨胀到气体压力也是100kpa; (3)等温可逆膨胀至气体的压力为100kPa 【解】(1)气体作恒外压膨胀:W=-P外△V故 W=-P9△V=-100×10Pa×(1×103)m3=.100J (2)W=-P9△V=-P8 nRT nRT P =-10mol×8.314J-K-1.mol1×300K 100KPa =.22.45KJ 1000KPa (3)W =-nRT In =-nRT in V P 1000KPa =.10mol×8.314JK-1mo×300K×h 100KPa =.57.43kJ 3 【3】1mol单原子理想气体,Cv,m=亏R,始态(1)的温度为273K,体积为22.4dm3, 2 经历如下三步,又回到始态,请计算每个状态的压力、Q、W和△U。 (1)等容可逆升温由始态(1)到546K的状态(2): (2)等温(546K)可逆膨胀由状态(2)到44.8dm3的状态(3): (3)经等压过程由状态(3)回到始态(1)。 【解】(1)由于是等容过程,则 W1=0 -9-
- 9 - 习题解答 【1】如果一个系统从环境吸收了 40J 的热,而系统的热力学能却增加了 200J,问系统 从环境得到了多少功?如果该系统在膨胀过程中对环境作了 10kJ 的功,同时吸收了 28kJ 的 热,求系统的热力学能变化值。 【解】 W=ΔU-Q=200J-40J=160J ΔU=Q+W=28kJ+(-10kJ)=18kJ 【2】有 10mol 的气体(设为理想气体),压力为 1000kPa,温度为 300K,分别求出温 度时下列过程的功: (1)在空气压力为 100kPa 时,体积胀大 1dm3; (2)在空气压力为 100kPa 时,膨胀到气体压力也是 100kpa; (3)等温可逆膨胀至气体的压力为 100kPa. 【解】(1)气体作恒外压膨胀: W = −P外V 故 W = −P V =-100×103Pa×(1×10-3)m3=-100J (2) = − = − = − − 1 2 2 1 1 P P nRT P nRT P nRT W P V P =-10mol×8.314J·K-1·mol-1×300K − KPa KPa 1000 100 1 =-22.45KJ (3) 2 1 1 2 ln ln P P nRT V V W = −nRT = − =-10mol×8.314J·K-1·mol-1×300K× KPa KPa 100 1000 ln =-57.43kJ 【3】1mol 单原子理想气体, CV m R 2 3 , = ,始态(1)的温度为 273K,体积为 22.4dm3, 经历如下三步,又回到始态,请计算每个状态的压力、Q、W 和 ΔU。 (1)等容可逆升温由始态(1)到 546K 的状态(2); (2)等温(546K)可逆膨胀由状态(2)到 44.8dm3 的状态(3); (3)经等压过程由状态(3)回到始态(1)。 【解】 (1)由于是等容过程,则 W1=0

R℃_1×8314×273=101.325KPa P1= V22.4×10-3 h=nRg-1×8314×546 22.4×10-3 202.65KPa AU1=Q+W1=Q=∫CvdT-∫nCv.mdT=nCvn(亿2-T) =1×3/2×8.314(546-273)=3404.58J (2)由于是等温过程,则 △U2=0 根据△U=Q+W得Q2=W2 又根据等温可逆过程得: wg=-mR7h5=-1×8314×546h448-3146.5J V 22.4 Q2=-W2=3146.5J (3).p3= nR℃3-1×8.314×546」 V344.8×10-3 101.325KPa 由于是循环过程则:△U=△U1+△U2+△U3=0 得△03=-(△U1+AU2)=-△U1=-3404.58J W3=-P△V=-P3(V3-V1)=101325×(0.0224-0.0448)=2269.68J Q3=△U3-W3=-3404.58J-2269.68J=-5674.26J 【4】在291K和100kPa下,1 molZn(s)溶于足量稀盐酸中,置换出1molH(g),并放热 152K」J。若以Zn和盐酸为系统,求该反应所做的功及系统热力学能的变化。 解该反应 Zn(s)+2HCl(a)=ZnCl2(s)+H2(g) 所以 W=一P外△V=p生成物-'反应物)≈pVH2 =-1mol×8.314J●K-1●mol-1×291K=-2.42kJ △U=Q+W=-152-2.42=-154.4kJ 【5】在298K时,有2molN2(g,始态体积为15dm,保持温度不变,经下列三个过程 膨胀到终态体积为50dm3,计算各过程的△U,△H,W和Q的值。设气体为理想气体。 (1)自由膨胀: (2)反抗恒外压100kPa膨胀: -10-
- 10 - KPa V nRT p 101.325 22.4 10 1 8.314 273 3 1 1 1 = = = − KPa V nRT p 202.65 22.4 10 1 8.314 546 3 1 2 2 = = = − ΔU1=Q1+W1=Q1= ( ) CV dT = nCV ,m dT = nCV ,m T2 −T1 =1×3/2×8.314(546-273)=3404.58J (2) 由于是等温过程,则 ΔU2=0 根据 ΔU=Q+W 得 Q2=-W2 又根据等温可逆过程得: W2= J V V nRT 3146.5 22.4 44.8 ln 1 8.314 546ln 2 3 − = − = − Q2=-W2=3146.5J (3). KPa V nRT p 101.325 44.8 10 1 8.314 546 3 3 3 3 = = = − 由于是循环过程则:ΔU=ΔU1+ΔU2+ΔU3=0 得 ΔU3=-(ΔU1+ΔU2)=-ΔU1=-3404.58J W3=-PΔV=-P3(V3-V1)=101325×(0.0224-0.0448)=2269.68J Q3=ΔU3-W3=-3404.58J-2269.68J=-5674.26J 【4】在 291K 和 100kPa 下,1molZn(s)溶于足量稀盐酸中,置换出 1molH2(g),并放热 152KJ。若以 Zn 和盐酸为系统,求该反应所做的功及系统热力学能的变化。 解 该反应 Zn(s)+2HCl(a)=ZnCl2(s)+H2(g) 所以 ( ) H2 W p V p V V p V = − 外 = 生成物 − 反应物 1mol 8.314J K mol 291K 2.42k J 1 1 = − • • = − − − U = Q +W = −152 − 2.42 = −154.4k J 【5】在 298K 时,有 2molN2(g),始态体积为 15dm3,保持温度不变,经下列三个过程 膨胀到终态体积为 50dm3,计算各过程的 ΔU,ΔH,W 和 Q 的值。设气体为理想气体。 (1)自由膨胀; (2)反抗恒外压 100kPa 膨胀;