
福建交通职业技术学院教案纸 第页 课程: 学年第—学期第—周月 日 教学内容 备注 第三章酸碱滴定法 §3.1酸碱平衡的理论基础 一、共轭酸碱 共轭酸,一共轭碱+什什 conjugate acid conjugate base proton 酸:HAc、HCI、NH4+、Fc(HO 碱:NH、NaOH、(C)6N4、 两性:HO、HPO2、HCO 1、酸碱共轭对一彼此只相差一个质子的一对共轭酸碱 NH3-NH4+HAc-Ac H3P04-H2P04- H2S-S2-(X)H2P04-P043-(X) 2、共轭酸碱对Ka与Kb的关系 Kakb-kw=1.0×10-14(25C)-(2-1) N-,长套=560W的) 飞-关=1x10e-c,k=关-56x104c的k) H3Po4、Kal、Ka2、Ka3 Ka 1 2 3 Kb321
福建交通职业技术学院教案纸 第 页 课程: 学年 第_ _学期 第 周 月 日 教 学 内 容 备 注 1 第三章 酸碱滴定法 §3.1 酸碱平衡的理论基础 一、共轭酸碱 酸:HAc、HCl、NH4+、Fe(H2O)6+ 碱:NH3、NaOH、(CH2)6N4、 两性:H2O、HPO4 2-、HCO3 - 1、酸碱共轭对-彼此只相差一个质子的一对共轭酸碱 NH3- NH4+ HAc-Ac H3PO4-H2PO4- H2S-S2- (×) H2PO4- PO43-(×) 2、共轭酸碱对 Ka 与 Kb 的关系 Ka.kb=kw=1.0×10-14(25℃)---(2-1) , 5.6 10 ( ) 4 10 4 3 a b w a NH k k k NH + − NH k = = − +的 5 1.8 10 − = = a w b k k k , 5.6 10 ( ) 10 b a w b Ac k k k HAc − Ac− k = = − −的 H3PO4、Ka1、Ka2、Ka3 3 1 a w b k k k = 2 2 a w b k k k = 1 3 a w b k k k = Ka 1 2 3 Kb 3 2 1

福建交通职业技术学院教案纸第页 课程 一学年第一学期第—周—月 日 教学内容 备注 §3-2水溶液中酸碱组分不同型体的分布 一、几个概念 分析浓度C、平衡浓度[小、酸的浓度、酸度pH=-gar 二、分布分数6 6= C 1、一元酸 HA(Cmol.L-I) HA-H++A k=] [HA] (H] ka CH+r[Hr]+kδx=CHh+k6+6。s1 例1计算pl=5.0时,0.1molL-1HAc溶液中各型体的平衡浓度。Ka=l.8×10~5 解:H+=1.0×103mol.L-1 、[H] u1+k=036 δe=1-d4=0.64 [HAc]=C8 HAc-0.036mol.L-[Ac]=C8 Ac-0.064mol.L-! 0.8 Q6 目 02 2 456H 分布曲线:6一pH (H] 8u-k. [H]=100k时,即 H门=时,即 pH=pk。-2,6e→1.0,6→0 e“+kpH=pk+2.k→10→0
福建交通职业技术学院教案纸 第 页 课程: 学年 第_ _学期 第 周 月 日 教 学 内 容 备 注 2 §3-2 水溶液中酸碱组分不同型体的分布 一、几个概念 分析浓度 C、平衡浓度[ ]、酸的浓度、酸度 = − + H pH lg a 二、分布分数δ A A C [A] = 1、一元酸 HA(Cmol.L-1) HA⇌H++A- 例 1 计算 pH=5.0 时,0.1mol.L-1HAc 溶液中各型体的平衡浓度。Ka=1.8×10-5 解:[H+]=1.0×10-5 mol.L-1 0.36 [ ] [ ] = + = + + a HA H k H − =1− = 0.64 Ac HA [HAc]=CδHAc=0.036mol.L-1 [Ac- ]=CδAc=0.064mol.L-1 分布曲线:δ-pH [ ] [ ][ ] HA H A ka + − = a HA H k H HA A HA C HA + = + = = + + − [ ] [ ] [ ] [ ] [ ] [ ] a a A H k k C A + = = + − − [ ] [ ] + − =1 HA A a HA H k H + = + + [ ] [ ] 2, 1.0, 0 [ ] 100 = − → → = − + a HAc Ac a pH pk H k 时,即 a a Ac H k k + = + − [ ] 2, 1.0, 0 100 1 [ ] = + → → = − + a Ac HAc a pH pk H k 时,即
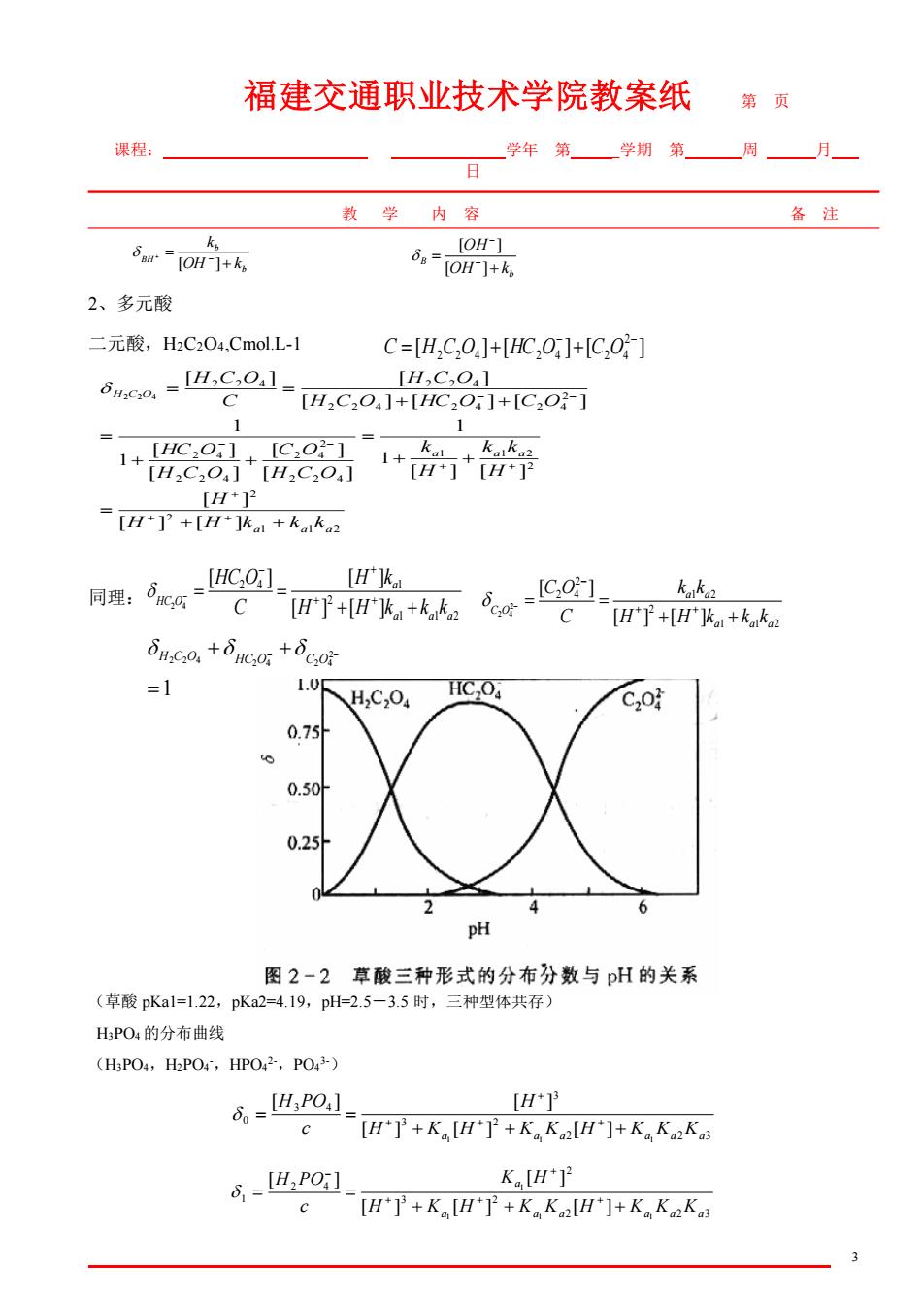
福建交通职业技术学院教案纸 第页 果程 学年第学期第一周—月一 日 教学内容 备注 5um-O [OH-] 8=OH +k 2、多元酸 二元酸,H2C204,Cmol.L-1 C=H,C,0]+[HC,0]+[C,O] Bnco.-IHC30. [H2C2O4] =H,C,O,1+[C,O]+[C,o] 1 1 1+c+ kk [H2C2O4][H2C2O4] 1+前+予 [H+ [H+]2+[H+]ko1+kk2 [HCO][Hka 同理:,g Co-Co HT+k+kk .++ =1 HC,O 0.7 0.50 pH 图2-2草酸三种形式的分布分数与pH的关系 (草酸pKa1=1.22,pKa2=4.19,pH-2.5-3.5时,三种型体共存) HPO1的分布曲线 (HPO,H2POr,HPO,PO) 8-IH,PO.] [H*] [H']+K[H'T +KK[H']+K KK 6,-UHPO:1 KH*]2 [H']+K [HT+Ka K2[H]+K K2K3
福建交通职业技术学院教案纸 第 页 课程: 学年 第_ _学期 第 周 月 日 教 学 内 容 备 注 3 2、多元酸 二元酸,H2C2O4,Cmol.L-1 1 1 2 2 2 2 1 1 2 2 2 4 2 2 4 2 2 4 2 4 2 2 2 4 2 4 2 4 2 2 4 2 2 4 [ ] [ ] [ ] [ ] [ ] 1 1 [ ] [ ] [ ] [ ] 1 1 [ ] [ ] [ ] [ ] [ ] 2 2 4 a a a a a a H C O H H k k k H H k k H k H C O C O H C O HC O H C O HC O C O H C O C H C O + + = + + = + + = + + = = + + + + + − − − − 同理: (草酸 pKa1=1.22,pKa2=4.19,pH=2.5-3.5 时,三种型体共存) H3PO4 的分布曲线 (H3PO4,H2PO4 -,HPO4 2-,PO4 3-) 2 2 3 3 2 3 3 4 0 1 1 1 [ ] [ ] [ ] [ ] [ ] H Ka H Ka Ka H Ka Ka Ka H c H PO + + + = = + + + + 2 2 3 3 2 2 2 4 1 1 1 1 1 [ ] [ ] [ ] [ ] [ ] a a a a a a a H K H K K H K K K K H c H PO + + + = = + + + − + b b BH OH k k + = − + [ ] b B OH k OH + = − − [ ] [ ] [ ] [ ] [ ] 2 2 2 4 2 4 2 4 − − C = H C O + HC O + C O 1 1 2 2 2 4 1 [ ] [ ] [ ] [ ] 2 4 a a a a HC O H H k k k H k C HC O + + = = + + − + − 1 1 2 2 1 2 2 2 4 [ ] [ ] [ ] 2 2 4 a a a a a C O H H k k k k k C C O + + = = + + − − 1 2 2 4 2 4 2 2 4 = + − + − H C O HC O C O

福建交通职业技术学院教案纸第页 课程: 学年第—学期第—周一月 日 教学内容 备注 6,[HPO KK[H] [HP+K.[H'F +K.KlH']+K.KK 6,=LPO] KaKaKo3 c HP+KHP+KKH门]+K,KK 1.0 0.8 0.6 0.1 2 68101214 pH pH=pK.时,[H3PO]=[H2PO] pH=pK时,[HPO]=[HPO] [H,PO]嘬大时H,PO,]=[HPO3pH=(pK+pK)=4.66 [HPO]最大时{H,PC]=PO)pH=(pK:+pKa)=9.74 优势区域图 ()HE,pKa=3.17 (2)HAc,pKa=4.76 (3)NH4+,pka=9.25 (4HC204,pka1=1,25,pKa2=4.29 (5⑤)HP,pKal=2.6,pKa2=7.2L,pKa3=12.32 己知HF的pKa=3.18,欲用HF掩蔽A1(四离子,pH应控制在多大? 答:pH>3.18
福建交通职业技术学院教案纸 第 页 课程: 学年 第_ _学期 第 周 月 日 教 学 内 容 备 注 4 2 2 3 3 2 2 2 4 2 1 1 1 1 [ ] [ ] [ ] [ ] [ ] a a a a a a a a H K H K K H K K K K K H c HPO + + + = = + + + − + 2 2 3 3 2 2 3 3 4 3 1 1 1 1 [ ] [ ] [ ] [ ] a a a a a a a a a H K H K K H K K K K K K c PO + + + = = + + + − [ ] [ ] 1 3 4 2 4 − pH = pKa 时,H PO = H PO( ) 4.66 2 1 [ ] [ ] [ ] 1 2 2 2 4 3 4 = 4 = + = − − H PO 最大时,H PO HPO ,pH pKa pKa ( ) 9.74 2 1 [ ] [ ] [ ] 2 3 3 2 4 4 2 4 = = + = − − − HPO 最大时,H P O P O ,pH pKa pKa 优势区域图 (1) HF, pKa = 3.17 (2) HAc, pKa = 4.76 (3) NH4+, pKa = 9.25 (4) H2C2O4, pKa1 = 1.25, pKa2 = 4.29 (5) H3PO4, pKa1 = 2.16, pKa2 = 7.21, pKa3 = 12.32 已知 HF 的 pKa = 3.18, 欲用 HF 掩蔽 Al (III) 离子,pH 应控制在多大? 答:pH >3.18 。 [ ] [ ] 2 2 2 4 4 − − pH = pKa 时,H PO = HPO

福建交通职业技术学院教案纸 第页 果程 学年第—学期第—周月 日 教学内容 备注 §3-3酸碱溶液pH值的计算 一、物料平衡,电荷平衡和质子条件 1、MBE (1)0.1mol.L-1HAc [HAc]+[Ac-]=0.Imol-L (2)写出各组分的MBE 2X10 Cu(NOs)+0.2NH.H0混合液 解:对C [Cu]+[Cu(NH)]++(Cu(NH)]=2x1molLNOi.[N]=xxxml NH [NH;]+[Cu(NH )]+2[Cu(NH3)]+5[Cu(NH ) =0.2mol.L (3)NH.HCO、NH)2CO NH4HCO3 [NH;]+[NH:]=[H,CO;]+[HCO]+[CO;] [NH ]+[NH:]=2([H,CO]+[HCO]+[COD) 2、CBE ∑正电荷=刀负电荷 Na,CO [Na]+[H*]=2[CO]+[HCO]+[OH] Cmol.LH,SO [H*]=[OH-]+[HSO]+2SO] =[OH-]+C+[SO-1.([HSO]+[SO:-]=C) PBE:[H]+[H,PO,]=[HPO-]+2PO]+[OH-] 3、PBE(本章的核心内容) 步骤:
福建交通职业技术学院教案纸 第 页 课程: 学年 第_ _学期 第 周 月 日 教 学 内 容 备 注 5 §3-3 酸碱溶液 pH 值的计算 一、物料平衡,电荷平衡和质子条件 1、MBE (1)0.1mol.L-1HAc 1 [ ] [ ] 0.1 − − HAc + Ac = mol L (2)写出各组分的 MBE 2×10-3Cu(NO3)2+0.2NH3.H2O 混合液 解:对 Cu2+ 2 3 1 3 5 2 3 2 [ ] [ ( ) ] [ ( ) ] 2 10 + + + − − Cu + Cu NH ++ Cu NH = mol L 3 3 1 3 3 ,[ ] 2 2 10 4 10 − − − − − NO NO = = mol L 1 2 3 5 2 3 2 2 3 3 3 0.2 ,[ ] [ ( ) ] 2[ ( ) ] 5[ ( ) ] − + + + = + + + + mol L NH NH Cu NH Cu NH Cu NH (3)NH4HCO3、(NH4)2CO3 NH4HCO3 [ ] [ ] [ ] [ ] [ ] 2 3 4 2 3 3 3 + − − NH + NH = H CO + HCO + CO [ ] [ ] 2([ ] [ ] [ ]) 2 3 4 2 3 3 3 + − − NH + NH = H CO + HCO + CO 2、CBE [正电荷] =[负电荷] [ ] [ ] 2[ ] [ ] [ ] 3 2 3 2 3 + + − − − Na + H = CO + HCO + OH Na CO [ ] [ ], ([ ] [ ] ) [ ] [ ] [ ] 2[ ] . 2 4 4 2 4 2 4 4 2 4 1 OH C SO HSO SO C H OH HSO SO Cmol L H SO = + + + = = + + − − − − + − − − − :[ ] [ ] [ ] 2[ ] [ ] 3 4 2 3 4 4 + − − − PBE H + H PO = HPO + PO + OH 3、PBE(本章的核心内容) 步骤: