
第十章卤素和氧族元素 本章重点介个绍卤素的诵性、单质的制各和性质:X的制各及其性质的弟变 :臭氧过氧化氢分子的结构及其性质 盐的性质:硫代硫酸盐、过二硫酸盐、焦硫酸盐的性质。 10-1p区元素概述 p区元素包括周期系中的ⅢA~IA和零族元素,该区元素沿 BSi-As-TeA对角线将其分为两部分,对角线右上角为非金属元素(含对角线 的 ),对角线左下角为10种金属元素。除氢外,所有非金属元素全部集 中在该区。 p区元素具有以下特点: ()与s区元素相似,P区同族自上而下原子半径逐渐增大,元素的金属性逐 渐增强非 金属性逐渐减弱。除ⅦA族外,都是由典型的非金属元素经准金属过渡 到典型的金属元素。 (2)p区元素(零族除外)原子的价层电子构型为s2p5,s、p电子均可 成键,由此它们具有多种氧化数,这点不同于s区元素。并且,随着价层加电 子的增多,失电子趋势减弱,逐渐变为共用电子,甚至得电子。因此, D区非金 属元素除有正氧化数外,还有负氧化数。ⅢAVA族同族 无素自上往下低氧化数 化合物的稳定性增强,高氧化数化合物的稳定性减弱,这种现象称为“惰性电子 对效应”。 ()p区金属的熔点一般较低,如: 元素Al Ga In TI Ge Sn Pb Sb Bi 熔点 /℃ 660.429.78156.6303.5973.4231.88327.5630.5271.3 化檬念属具有半得体性质,为制造半号体的重婴原料,如超纯结、种 10-2卤素元素 ①由两种肉素组成的二元化合物称为卤素互化物,它们的组成可用XX表示 =1、3、5、7),其中X的电负性大于X,两者的电负性相差越大,n值也越大。 由于它们均为卤素,电负性差值不会很大,所以它们之间形成共价化合物
第十章 卤素和氧族元素 本章重点介绍卤素的通性、单质的制备和性质;HX 的制备及其性质的递变 规律;氯的含氧酸及其盐的性质和递变规律;臭氧过氧化氢分子的结构及其性质; 硫化氢和多硫化氢的性质、金属硫化物的溶解性;硫酸分子的结构;亚硫酸及其 盐的性质;硫代硫酸盐、过二硫酸盐、焦硫酸盐的性质。 10-1 p 区元素概述 p 区元素包括周期系中的 ⅢA~ⅦA 和零族元素,该区元素沿 B-Si-As-Te-At 对角线将其分为两部分,对角线右上角为非金属元素(含对角线 上的元素),对角线左下角为 10 种金属元素。除氢外,所有非金属元素全部集 中在该区。 p 区元素具有以下特点: (1) 与 s 区元素相似,p 区同族自上而下原子半径逐渐增大,元素的金属性逐 渐增强非金属性逐渐减弱。除ⅦA 族外,都是由典型的非金属元素经准金属过渡 到典型的金属元素。 (2) p 区元素(零族除外)原子的价层电子构型为 ns 2 np 1-5,ns、np 电子均可 成键,由此它们具有多种氧化数,这点不同于 s 区元素。并且,随着价层 np 电 子的增多,失电子趋势减弱,逐渐变为共用电子,甚至得电子。因此,p 区非金 属元素除有正氧化数外,还有负氧化数。ⅢA-ⅤA 族同族元素自上往下低氧化数 化合物的稳定性增强,高氧化数化合物的稳定性减弱,这种现象称为“惰性电子 对效应”。 (3) p 区金属的熔点一般较低,如: 元素 Al Ga In Tl Ge Sn Pb Sb Bi 熔点 /℃ 660.4 29.78 156.6 303.5 973.4 231.88 327.5 630.5 271.3 (4) p 区某些金属具有半导体性质,为制造半导体的重要原料,如超纯锗、砷 化稼、锑化镓等。 10-2 卤素元素 ①由两种卤素组成的二元化合物称为卤素互化物,它们的组成可用 XX'n 表示 (n=1、3、5、7),其中 X'的电负性大于 X,两者的电负性相差越大,n 值也越大。 由于它们均为卤素,电负性差值不会很大,所以它们之间形成共价化合物

10-2-1卤素元素通性 卤素元素又称卤素,是周期系第I族元素:氟(F)、氯(CI)、溴(B) 碘(D、破(A)的总称。卤素的希腊文原意为成盐元素。在自然界,氟主要 以萤石(CF)和冰晶石(Na AIF6)等矿物存在,氯、溴、碘主要以钠、钾、 钙、镁的无机盐形式存在于海水中,海藻是碘的重要来源,砹为放射性元素,仅 以微量且短暂地存在铀和钍的蜕变产物中。有关卤族元素的一些基本性质列于表 11-1中。 表111卤族元素的基本性质 元素 氟F)氯(CI)溴Br)碘① 原子序数 9 17 35 53 价层电子构 2s22p 3s23p 4s24p 5s25p -1、0、+1、 主要氧化数 -1、0、+1、 -1、0、+1、 -1、0 +3、+7、 +3、+7、+5 +3、+7、+5 +5 原子半径 64 99 114 133 /pm 第一电离能 1681 1251 1140 1/(kJ-mor') 1008 电子亲合能 B州 -327.9 -349 -324.7 -295.1 (kJ-mol) 电负性 4.0 3.0 2.8 2.5 卤素原子的价层电子构型为sm,与稳定的8电子构型sp比较,仅 缺少一个电子:核电荷是同周期元素中最多的(稀有气体除外),原子半径是同周 期元素中最小的,故它们最容易取得电子。卤素和同周期元素相比较,其非金属 是最强的。在本族内由于自上往下电负性逐渐减小,因而从氟到碘非金属性依次 减弱。 从表111数据看,卤素原子的第一电离能都很大,这决定了卤素原子在化 学变化中要失去电子成为阳离子是困难的。事实上在卤素中只有电离能最小、半 径最大的碘才有这种可能。例如可以形成碘盐1(CHCOO、I(CIO)3等。 卤素在化合物中最常见的氧化数为1。由于氟的电负性最大,所以不可能表 现出正氧化数。其它卤族元素,如与电负性较大的元素化合(例如形成卤素的 氧酸及其盐或卤素互化物P),可以表现出正氧化数:+1、3、+5和+7,而且相邻 氧化数之间的差数均为2,这是由于卤素原子的价层电子排布为sp,其中6
10-2-1 卤素元素通性 卤素元素又称卤素,是周期系第Ⅶ族元素:氟(F)、氯(Cl)、溴(Br)、 碘(I)、砹(At)的总称。卤素的希腊文原意为成盐元素。在自然界,氟主要 以萤石(CaF2)和冰晶石(Na3AlF6)等矿物存在,氯、溴、碘主要以钠、钾、 钙、镁的无机盐形式存在于海水中,海藻是碘的重要来源,砹为放射性元素,仅 以微量且短暂地存在铀和钍的蜕变产物中。有关卤族元素的一些基本性质列于表 11-1 中。 表 11-1 卤族元素的基本性质 元素 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子序数 9 17 35 53 价层电子构 型 2s2 2p5 3s2 3p5 4s2 4p5 5s2 5p5 主要氧化数 -1、0 -1、0、+1、 +3、+7、+5 -1、0、+1、 +3、+7、 +5 -1、0、+1、 +3、+7、+5 原子半径 /pm 64 99 114 133 第一电离能 I1/(kJ·mol-1 ) 1681 1251 1140 1008 电子亲合能 (kJ·mol-1 ) -327.9 -349 -324.7 -295.1 电负性 4.0 3.0 2.8 2.5 卤素原子的价层电子构型为 ns 2 np 5, 与稳定的 8 电子构型 ns 2 np 6比较,仅 缺少一个电子;核电荷是同周期元素中最多的(稀有气体除外),原子半径是同周 期元素中最小的,故它们最容易取得电子。卤素和同周期元素相比较,其非金属 是最强的。在本族内由于自上往下电负性逐渐减小,因而从氟到碘非金属性依次 减弱。 从表 11-1 数据看,卤素原子的第一电离能都很大,这决定了卤素原子在化 学变化中要失去电子成为阳离子是困难的。事实上在卤素中只有电离能最小、半 径最大的碘才有这种可能。例如可以形成碘盐 I(CH3COO)3、I(ClO4)3 等。 卤素在化合物中最常见的氧化数为-1。由于氟的电负性最大,所以不可能表 现出正氧化数。其它卤族元素,如与电负性较大的元素化合(例如形成卤素的含 氧酸及其盐或卤素互化物①),可以表现出正氧化数:+1、3、+5 和+7,而且相邻 氧化数之间的差数均为 2,这是由于卤素原子的价层电子排布为 ns 2 np 5,其中 6

个电子已成对,一个电子未成对,所以当参加反应时,先是未成对的电子参与成 键,以后每拆开一对电子就可多形成两个共价键。 氟与有多种氧化数的元素化合时 该元素往往可以呈现最高氧化数,例如 As,SF。,和F等.这是由于氯原子半径小空间位阻不大,因此中心原子的 周围可以容纳较多的氟原子,而对氯、溴、碘原子则较为困难。 10-2-2卤素单质 1,物理性质 岗素单质皆为双原子分子,固态时为分子(非极性)品体, 因此熔占进占都化较任。随着卤素原子半径的增大和核外电于数日的增多, 素分子之间的色散力逐渐增大 因而卤素单质的熔点 、沸点 理性质按F-C1Br-I顺序依次增大。卤素单质的一些物理性质见表11-2。 表11-2卤素单质的物理性质 肉素单质 氟 氯溴 聚集状态 气 气液 固 额色 浅黄黄绿红棕紫黑 熔点/℃ -219.6-101 -7.2113.5 沸点/℃ -188 -34.658.78184.3 AwHe 6.3220.4130.71 46.61 /(kJmor) 溶解度 分解 0.7323.580.029 /g(100gH20 水 密度(gcm)1.110)1.570)3.1204.93s) 在常温下,氟、氯是气体,溴是易挥发的液体,碘是固体。氯在常温下加压 便成为黄色液体,利用这一性质,可将氯液化装在钢瓶中贮运。固态碘在熔化前 己具有相当大的蒸气压,适当加热即可升华,利用碘的这一性质,可将粗碘进行 精制。 卤素单质均有颜色。随着分子相对质量的增大,卤素单质颜色依次加深。 卤素单质在水中的溶解度不大(氟与水激烈反应例外)。氯、溴、碘的水溶液 分别称为氯水、溴水和碘水。卤素单质在有机溶剂中的溶解度比在水中的溶解度 大得多。溴可溶于乙醇、乙醚、氯仿、四氯化碳、二硫化碳等溶剂中,溴溶液的 颜色随溴浓度的增大而从黄到棕红。碘溶液的颜色随溶剂的不同而有所差异, 般来说,在介电常数较大的溶剂(如水、醇、醚和酯)中, 碘呈棕色或红棕色:在 介电常数较小的溶剂(如四氯化碳和二硫化碳)中,则呈本身蒸汽的紫色。碘溶液
个电子已成对,一个电子未成对,所以当参加反应时,先是未成对的电子参与成 键,以后每拆开一对电子就可多形成两个共价键。 氟与有多种氧化数的元素化合时,该元素往往可以呈现最高氧化数,例如 AsF5,SF6,和 IF7 等。这是由于氟原子半径小,空间位阻不大,因此中心原子的 周围可以容纳较多的氟原子,而对氯、溴、碘原子则较为困难。 10-2-2 卤素单质 1.物理性质 卤素单质皆为双原子分子,固态时为分子(非极性)晶体, 因此熔点、沸点都比较低。随着卤素原子半径的增大和核外电子数目的增多,卤 素分子之间的色散力逐渐增大,因而卤素单质的熔点、沸点、气化焓和密度等物 理性质按 F-Cl-Br-I 顺序依次增大。卤素单质的一些物理性质见表 11-2。 表 11-2 卤素单质的物理性质 卤素单质 氟 氯 溴 碘 聚集状态 气 气 液 固 颜色 浅黄 黄绿 红棕 紫黑 熔点/℃ -219.6 -101 -7.2 113.5 沸点/℃ -188 -34.6 58.78 184.3 /(kJ·mol-1 ) 6.32 20.41 30.71 46.61 溶解度 /g·(100gH2O)-1 分解 水 0.732 3.58 0.029 密度/(g·cm-3 ) 1.11(l) 1.57(l) 3.12(l) 4.93(s) 在常温下,氟、氯是气体,溴是易挥发的液体,碘是固体。氯在常温下加压 便成为黄色液体,利用这一性质,可将氯液化装在钢瓶中贮运。固态碘在熔化前 已具有相当大的蒸气压,适当加热即可升华,利用碘的这一性质,可将粗碘进行 精制。 卤素单质均有颜色。随着分子相对质量的增大,卤素单质颜色依次加深。 卤素单质在水中的溶解度不大(氟与水激烈反应例外)。氯、溴、碘的水溶液 分别称为氯水、溴水和碘水。卤素单质在有机溶剂中的溶解度比在水中的溶解度 大得多。溴可溶于乙醇、乙醚、氯仿、四氯化碳、二硫化碳等溶剂中,溴溶液的 颜色随溴浓度的增大而从黄到棕红。碘溶液的颜色随溶剂的不同而有所差异,一 般来说,在介电常数较大的溶剂(如水、醇、醚和酯)中,碘呈棕色或红棕色;在 介电常数较小的溶剂(如四氯化碳和二硫化碳)中,则呈本身蒸汽的紫色。碘溶液

颜色的不同是由于碘在极性溶剂中形成溶剂化物,而在非极性或弱极性溶剂中碘 不发生溶剂化作用,溶解的碘以分子状态存在 碘难溶于水,但易溶于碘化物溶液(如碘化钾)中,这主要是由于生成的缘故: I+I广=I 此反应是因为「接近上分子时,使2分子极化产生诱导偶极,然后彼此以静 电吸引形成。1可以解离而生成2,故多碘化物溶液的性质实际上和碘溶液相 同。实验室常用此反应获得较大浓度的碘水溶液。氯和溴也能形成C1:和B 不过这两种离子都很不稳定 气态卤素单质均有刺激性气味,强烈刺激眼、鼻、气管等粘膜,吸入较多蒸 气会严重中毒(其毒性从氟到碘依次减小),甚至会造成死亡,所以使用卤素单质 时应特别小心。若不慎猛吸入一口氯气,当即会室息、呼吸困难。此时应立即去 室外,也可吸入少量氨气解毒,严重的须及时抢救。液溴对皮肤能造成难以痊愈 的灼伤,若溅到身上,应立即用大量水冲洗,再用5%NaHCOs,溶液淋洗后敷 上油膏 10-2-3卤化氢和氢卤酸 1.卤化氢和氢卤酸的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。工业上合 成盐酸是用氢气流在氯气中燃烧的方法,生成的氯化氢再用水吸收即成盐酸。其 反应过程为:首先氯分子在加热或强光照射下分解成氯原子 氯原子与氢分子反应,生成HC分子和氢原子: C1+H2-→HCI+H 接着氢原子又和氯分子作用: H+C12 →HCI+CI 反应继续下去。这样的连续反应称为连锁反应(或链式反应。连锁反应在自然界 很普遍,很多的爆炸、燃烧反应都为连锁反应。制备氟化氢及少量氯化氢时,可 用浓硫酸与相应的卤化物作用: CaF2+2H2SO4(浓)-Ca(HSO4b+2HF↑ -NaHSO4+HCI1 但这种方法不活用王溴化氢和碘化氢 由于磷酸为不挥发的非氧化性酸,可用以代替硫酸制备溴化氢和碘化氢。 实验室中常用非金属卤化物水解的方法制备溴化氢和碘化氢。例如用水滴入 三溴化磷和三碘化磷表面即可产生溴化氢和碘化氢: PBr+3HO-→HPO3+3HBr1 P H.C H:PO3T 实际使用时,并不需要先制成非金属卤化物,而是将溴逐滴加入到磷与少量水的 混合物中或将水逐滴加入到碘与磷的混合物中,这样溴化氢或碘化氢即可不断产 生: 3Brt 2P++6HBrt 3+2P+6H0 -→2HP03+6HIt
颜色的不同是由于碘在极性溶剂中形成溶剂化物,而在非极性或弱极性溶剂中碘 不发生溶剂化作用,溶解的碘以分子状态存在。 碘难溶于水,但易溶于碘化物溶液(如碘化钾)中,这主要是由于生成 I3 -的缘故: I2 + I-=I3 - 此反应是因为 I -接近 I2分子时,使 I2分子极化产生诱导偶极,然后彼此以静 电吸引形成 I3 -。I3 -可以解离而生成 I2,故多碘化物溶液的性质实际上和碘溶液相 同。实验室常用此反应获得较大浓度的碘水溶液。氯和溴也能形成 C13 -;和 Br3 -, 不过这两种离子都很不稳定。 气态卤素单质均有刺激性气味,强烈刺激眼、鼻、气管等粘膜,吸入较多蒸 气会严重中毒(其毒性从氟到碘依次减小),甚至会造成死亡,所以使用卤素单质 时应特别小心。若不慎猛吸入一口氯气,当即会窒息、呼吸困难。此时应立即去 室外,也可吸入少量氨气解毒,严重的须及时抢救。液溴对皮肤能造成难以痊愈 的灼伤,若溅到身上,应立即用大量水冲洗,再用 5%NaHCO3,溶液淋洗后敷 上油膏。 10-2-3 卤化氢和氢卤酸 1.卤化氢和氢卤酸的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。工业上合 成盐酸是用氢气流在氯气中燃烧的方法,生成的氯化氢再用水吸收即成盐酸。其 反应过程为:首先氯分子在加热或强光照射下分解成氯原子: C12 C1 + C1 氯原子与氢分子反应,生成 HCl 分子和氢原子: C1 + H2 ─→ HCl + H 接着氢原子又和氯分子作用: H + C12 ─→ HCl + Cl 反应继续下去。这样的连续反应称为连锁反应(或链式反应)。连锁反应在自然界 很普遍,很多的爆炸、燃烧反应都为连锁反应。制备氟化氢及少量氯化氢时,可 用浓硫酸与相应的卤化物作用: CaF2 + 2H2SO4(浓) ─→ Ca(HSO4)2 + 2HF↑ NaCl + H2SO4(浓) ─→ NaHSO4 + HCl↑ 但这种方法不适用于溴化氢和碘化氢。 由于磷酸为不挥发的非氧化性酸,可用以代替硫酸制备溴化氢和碘化氢。 实验室中常用非金属卤化物水解的方法制备溴化氢和碘化氢。例如用水滴入 三溴化磷和三碘化磷表面即可产生溴化氢和碘化氢: PBr3 + 3H2O ─→ H3PO3 + 3HBr↑ PI3 + 3H2O ─→ H3PO3 + 3HI↑ 实际使用时,并不需要先制成非金属卤化物,而是将溴逐滴加入到磷与少量水的 混合物中或将水逐滴加入到碘与磷的混合物中,这样溴化氢或碘化氢即可不断产 生: 3Br2 + 2P + 6H2O ─→ 2H3PO3 + 6HBr↑ 3I2 + 2P + 6H2O ─→ 2H3PO3 + 6HI↑
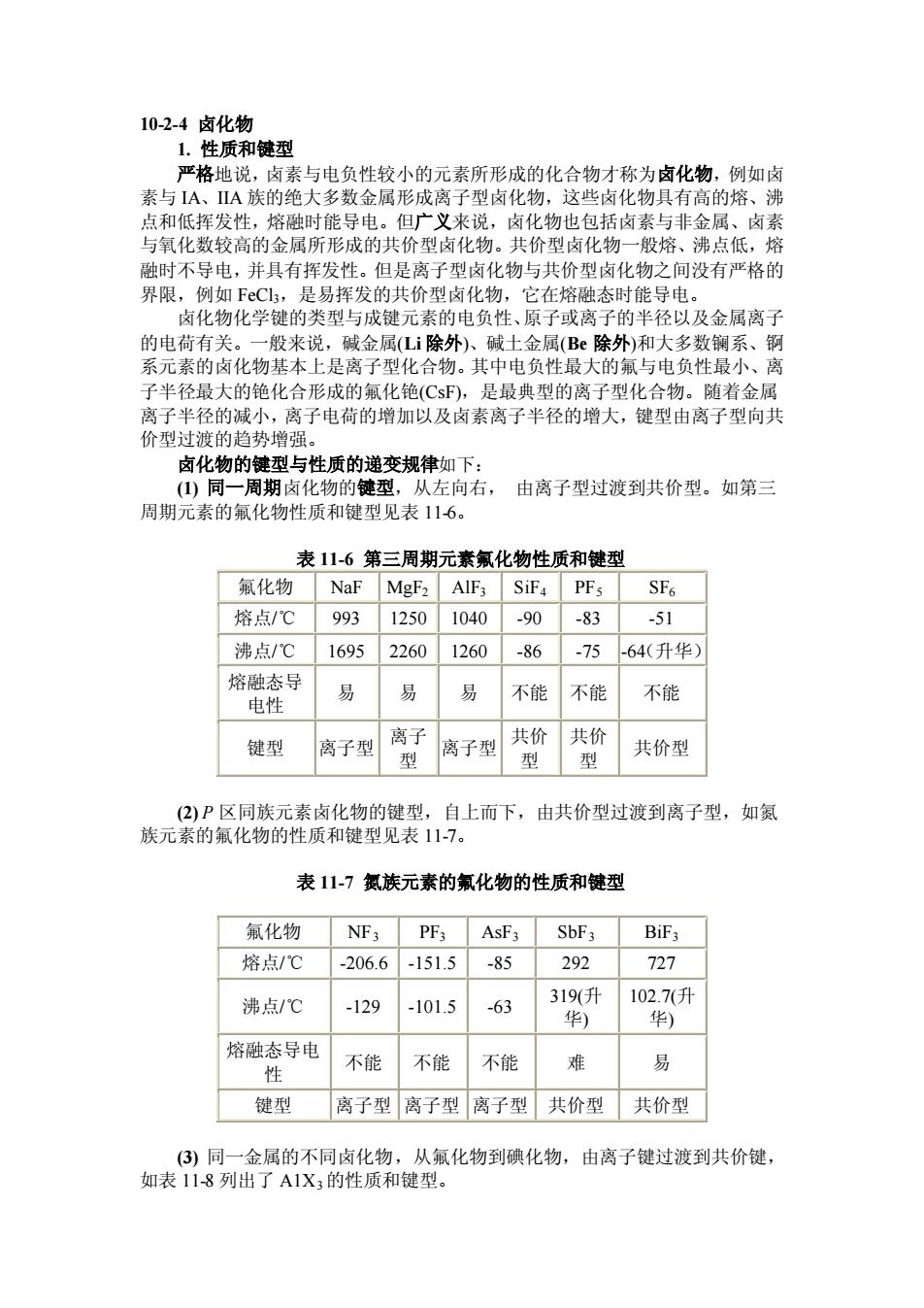
10-2-4卤化物 1.性质和键型 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物 ,例如卤 素与A、ⅡA族的绝大多数金属形成离子型卤化物,这些卤化物具有高的熔、沸 点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、卤素 与氧化数较高的金屈所形成的共价型卤化物。共价型卤化物一般熔、沸点低,熔 融时不导电,并具有挥发性。但是离子型卤化物与共价型卤化物之间没有严格的 界限,例如FeCl, 是易探发的址价利化物 它在熔融态时能导电】 卤化物化学键的类型与成键元素的电负性、原子或离子的半径以及金属离了 的电荷有关。 ~般来说,碱金属(Li除外)、碱土金属(B除外)和大多数镧系、铜 系元素的卤化物基本上是离子型化合物。其中电负性最大的氟与电负性最小、离 子半径最大的铯化合形成的氟化铯(CsF),是最典型的离子型化合物。随者金属 离子半径的减小,离子电荷的增加以及卤素离子半径的增大,键型由离子型向共 价型过渡的趋势增强 卤化物的键型与性质的递变规律如下: (仙)同一周期卤化物的键型,从左向右,由离子型过渡到共价型。如第三 周期元素的氟化物性质和键型见表116。 表11-6第三周期元素氟化物性质和键型 氟化物NaF MgF2AIF3SiF4 PFs SF6 熔点/℃993 12501040-90 -83 51 沸点/℃1695 22601260 -86 -75-64(升华) 熔种态马 电性 易 易 不能不能 不能 键型离子型离 离子型 共价共价 型 型 共价型 (2)P区同族元素卤化物的键型,自上而下,由共价型过渡到离子型,如氨 族元素的氟化物的性质和键型见表117。 表11-7氮族元素的氟化物的性质和键型 氟化物NF;PF;AsF3SbF3BF; 熔点/℃ -206.6-151.5 -85 292 727 沸点/℃ 129 -101.5 -63 319(升 102.7(升 华) 华) 熔融态导电 性 不能 不能 不能 易 键型 离子型离子型离子型共价型共价型 (③)同一金属的不同卤化物,从氟化物到碘化物,由离子键过渡到共价键, 如表11-8列出了A1X,的性质和键型
10-2-4 卤化物 1. 性质和键型 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物,例如卤 素与 IA、IIA 族的绝大多数金属形成离子型卤化物,这些卤化物具有高的熔、沸 点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、卤素 与氧化数较高的金属所形成的共价型卤化物。共价型卤化物一般熔、沸点低,熔 融时不导电,并具有挥发性。但是离子型卤化物与共价型卤化物之间没有严格的 界限,例如 FeCl3,是易挥发的共价型卤化物,它在熔融态时能导电。 卤化物化学键的类型与成键元素的电负性、原子或离子的半径以及金属离子 的电荷有关。一般来说,碱金属(Li 除外)、碱土金属(Be 除外)和大多数镧系、锕 系元素的卤化物基本上是离子型化合物。其中电负性最大的氟与电负性最小、离 子半径最大的铯化合形成的氟化铯(CsF),是最典型的离子型化合物。随着金属 离子半径的减小,离子电荷的增加以及卤素离子半径的增大,键型由离子型向共 价型过渡的趋势增强。 卤化物的键型与性质的递变规律如下: (1) 同一周期卤化物的键型,从左向右, 由离子型过渡到共价型。如第三 周期元素的氟化物性质和键型见表 11-6。 表 11-6 第三周期元素氟化物性质和键型 氟化物 NaF MgF2 AlF3 SiF4 PF5 SF6 熔点/℃ 993 1250 1040 -90 -83 -51 沸点/℃ 1695 2260 1260 -86 -75 -64(升华) 熔融态导 电性 易 易 易 不能 不能 不能 键型 离子型 离子 型 离子型 共价 型 共价 型 共价型 (2) P 区同族元素卤化物的键型,自上而下,由共价型过渡到离子型,如氮 族元素的氟化物的性质和键型见表 11-7。 表 11-7 氮族元素的氟化物的性质和键型 氟化物 NF3 PF3 AsF3 SbF3 BiF3 熔点/℃ -206.6 -151.5 -85 292 727 沸点/℃ -129 -101.5 -63 319(升 华) 102.7(升 华) 熔融态导电 性 不能 不能 不能 难 易 键型 离子型 离子型 离子型 共价型 共价型 (3) 同一金属的不同卤化物,从氟化物到碘化物,由离子键过渡到共价键, 如表 11-8 列出了 A1X3的性质和键型