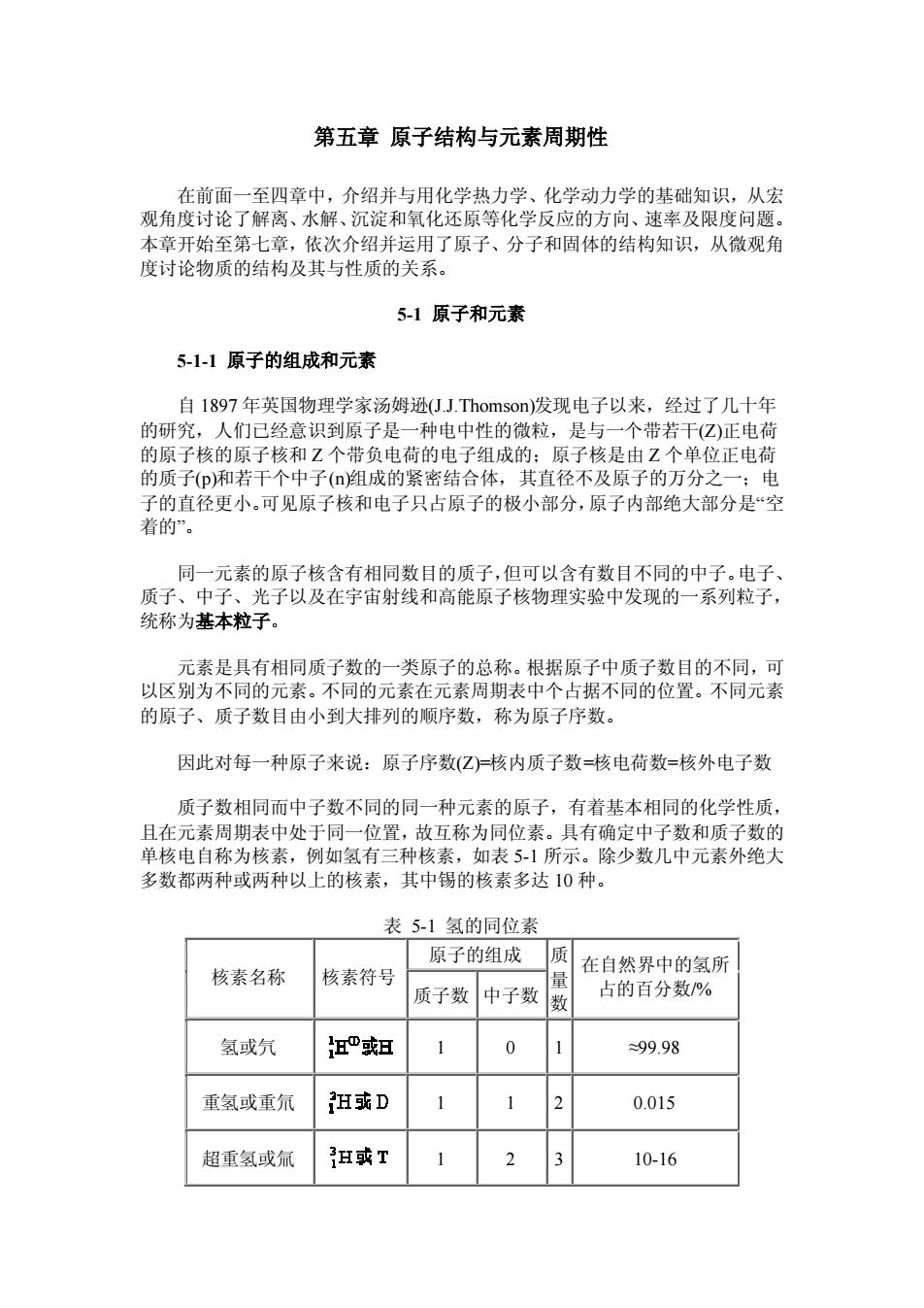
第五章原子结构与元素周期性 在前面一至四章中,介绍并与用化学热力学、化学动力学的基础知识,从宏 观角度讨论了解离、水解、沉淀和氧化还原等化学反应的方向、速率及限度问题。 本章开始至第七章,依次介绍并运用了原子、分子和固体的结构知识,从微观角 度讨论物质的结构及其与性质的关系。 5-1原子和元素 5-1-1原子的组成和元素 自1897年英国物理学家汤姆逊J.Thomson)发现电子以来,经过了几十年 的研究,人们已经意识到原子是一种电中性的微粒,是与一个带若干(Z)正电荷 的原子核的原子核和Z个带负电荷的电子组成的:原子核是由Z个单位正电荷 的质子(P和若干个中子(口)阻成的紧密结合体,其直径不及原子的万分之一:电 子的直径更小。可见原子核和电子只占原子的极小部分,原子内部绝大部分是“空 着的”. 同一元素的原子核含有相同数目的质子,但可以含有数目不同的中子。电子、 质子、中子、光子以及在字宙射线和高能原子核物理实验中发现的一系列粒子, 统称为基本粒子。 元素是具有相同质子数的一类原子的总称。根据原子中质子数目的不同,可 以区别为不同的元素。不同的元素在元素周期表中个占据不同的位置。不同元素 的原子、质子数目由小到大排列的顺序数,称为原子序数, 因此对每一种原子来说:原子序数(Z)核内质子数=核电荷数=核外电子数 质子数相同而中子数不同的同一种元素的原子,有着基本相同的化学性质, 且在元素周期表中处于同一位置,故互称为同位素。具有确定中子数和质子数的 单核电自称为核素,例如氢有三种核素,如表51所示。除少数几中元素外绝大 多数都两种或两种以上的核素,其中锡的核素多达10种。 表51氢的同位素 原子的组成质 核素名称 核素符号 在自然界中的氢所 质子数中子数数 占的百分数% 氢或氕 坦”短 1 0 1 99.98 重氢或重氘 狂或D 1 1 0.015 超重氢或氚 H或T 1 2 3 10-16
第五章 原子结构与元素周期性 在前面一至四章中,介绍并与用化学热力学、化学动力学的基础知识,从宏 观角度讨论了解离、水解、沉淀和氧化还原等化学反应的方向、速率及限度问题。 本章开始至第七章,依次介绍并运用了原子、分子和固体的结构知识,从微观角 度讨论物质的结构及其与性质的关系。 5-1 原子和元素 5-1-1 原子的组成和元素 自 1897 年英国物理学家汤姆逊(J.J.Thomson)发现电子以来,经过了几十年 的研究,人们已经意识到原子是一种电中性的微粒,是与一个带若干(Z)正电荷 的原子核的原子核和 Z 个带负电荷的电子组成的;原子核是由 Z 个单位正电荷 的质子(p)和若干个中子(n)组成的紧密结合体,其直径不及原子的万分之一;电 子的直径更小。可见原子核和电子只占原子的极小部分,原子内部绝大部分是“空 着的”。 同一元素的原子核含有相同数目的质子,但可以含有数目不同的中子。电子、 质子、中子、光子以及在宇宙射线和高能原子核物理实验中发现的一系列粒子, 统称为基本粒子。 元素是具有相同质子数的一类原子的总称。根据原子中质子数目的不同,可 以区别为不同的元素。不同的元素在元素周期表中个占据不同的位置。不同元素 的原子、质子数目由小到大排列的顺序数,称为原子序数。 因此对每一种原子来说:原子序数(Z)=核内质子数=核电荷数=核外电子数 质子数相同而中子数不同的同一种元素的原子,有着基本相同的化学性质, 且在元素周期表中处于同一位置,故互称为同位素。具有确定中子数和质子数的 单核电自称为核素,例如氢有三种核素,如表 5-1 所示。除少数几中元素外绝大 多数都两种或两种以上的核素,其中锡的核素多达 10 种。 表 5-1 氢的同位素 原子的组成 核素名称 核素符号 质子数 中子数 质 量 数 在自然界中的氢所 占的百分数/% 氢或氕 1 0 1 ≈99.98 重氢或重氘 1 1 2 0.015 超重氢或氚 1 2 3 10-16

根据来源和稳定性,可将核素分为稳定核素和放射性核素。放射性核素的原 子核不稳定,能放出射线而蜕变成别的元素。目前已发现的118种元素的核素己 达2000种左右· 质量数相同而原子系数不同的元素,互称为异序同量素,简称同量素。 ①元素符号左上角的数字表示质量数,左下角的数字表示原子序数。 51-2反原子和反物质 1932年美国物理学家安德森(C.D.Anderson)在字宙线实验中发现了与电子质 量相同带单位正电荷的粒子 正电子(e):1956年美国物玛 学家张伯伦 (O.Chamberlain)等在加速器实验中发现了质量与正质子p*)相同带单位负电荷的 粒子一负质子)。以后又陆续发现了许多类似的情况,证实一切粒子都有与 之相对应的反粒子①。例如中子不带电但一定有磁性,反中子则呈相反的磁性。 ①反粒子的概念最初数英国物理学家狄拉克P.M.A.Dirac))提出来的 据报道,欧洲核子研究中心的德国和意大利科学家从1995年9月开始的实 验,已经成功的获得了反氢原子(有一个反质子p和一个反电子结合而成),亦 即获得了反物质。尽管这种反氢原子只能存在极短瞬间,但这项实验不仅为系统 的探索反物质世界打开了大门,而且为自然辩证法提供了极为有利的佐证,具有 5-1-3原子轨道能级 1913年玻尔在前人工作的基础上提出了玻尔原子模型,其要点如下: 1.定态轨道概念 氢原子中的电子是在氢原子核的势能场中运动,其运动轨道不是任意的,电 子只能在以原子核为中心的某些能量(E)确定的圆形轨道上运动。这些轨道的能 量状态不随时间而改变,因此被称为定态轨道。电子在定态轨道上运动时,既不 吸收也不释放能量 2.轨道能级的概念 ()最简单的原子—氢原子的光谱 (2)轨道能级的概念 不同的定态轨道能量是不同的。离核越近的轨道,能量越低,电子被原子核 束缚得越牢:离核越远的轨道,能量越高。轨道的这些能量状态,称为能级。氢 原子轨道能级如图51所示
根据来源和稳定性,可将核素分为稳定核素和放射性核素。放射性核素的原 子核不稳定,能放出射线而蜕变成别的元素。目前已发现的 118 种元素的核素已 达 2000 种左右。 质量数相同而原子系数不同的元素,互称为异序同量素,简称同量素。 ──────────────────────────────────── ① 元素符号左上角的数字表示质量数,左下角的数字表示原子序数。 *5-1-2 反原子和反物质 1932年美国物理学家安德森(C.D.Anderson)在宇宙线实验中发现了与电子质 量相同带单位正电荷的粒子— — 正电子(e+ );1956 年美国物理学家张伯伦 (O.Chamberlain)等在加速器实验中发现了质量与正质子(p+ )相同带单位负电荷的 粒子— — 负质子(p- )。以后又陆续发现了许多类似的情况,证实一切粒子都有与 之相对应的反粒子① 。例如中子不带电但一定有磁性,反中子则呈相反的磁性。 ① 反粒子的概念最初数英国物理学家狄拉克(P.M.A.Dirac)提出来的。 据报道,欧洲核子研究中心的德国和意大利科学家从 1995 年 9 月开始的实 验,已经成功的获得了反氢原子(有一个反质子 p -和一个反电子 e +结合而成),亦 即获得了反物质。尽管这种反氢原子只能存在极短瞬间,但这项实验不仅为系统 的探索反物质世界打开了大门,而且为自然辩证法提供了极为有利的佐证,具有 5-1-3 原子轨道能级 1913 年玻尔在前人工作的基础上提出了玻尔原子模型,其要点如下: 1. 定态轨道概念 氢原子中的电子是在氢原子核的势能场中运动,其运动轨道不是任意的,电 子只能在以原子核为中心的某些能量(En)确定的圆形轨道上运动。这些轨道的能 量状态不随时间而改变,因此被称为定态轨道。电子在定态轨道上运动时,既不 吸收也不释放能量。 2. 轨道能级的概念 (1) 最简单的原子──氢原子的光谱 (2) 轨道能级的概念 不同的定态轨道能量是不同的。离核越近的轨道,能量越低,电子被原子核 束缚得越牢;离核越远的轨道,能量越高。轨道的这些能量状态,称为能级。氢 原子轨道能级如图 5-1 所示

(3)基态与激发态 在正常状态下,电子尽可能处于离核较近、能量较低的轨道上,这时原子所 处的状态称为基态 ,在高温火焰下,电火花或电弧作用下,基态原子中的 获得能量,能跃迁到离核较远、能量较高的空轨道上去运动,这时原子所处的状 态称为激发态。n一∞时,电子所处的轨道能量定为零,意味者电子被激发到 这样的能级时,由于获得足够大的能量,可以完全摆脱核势能场的束缚而电离 因此,离核越近的轨道,能级越低,势能值越负。 3.玻尔原子模型的应用范围与局限性 玻尔原子模型成功的解释了氢原子和类氢原子(如H,Li2+,Be3)的光谱现 象。时至今日,玻尔提出的关于原子中轨道能级的概念,仍然有用。但是玻尔理 论有着严重的局限性,它只能解释单电子原子(或离子)光谱的一般现象,不能解 释多电子原子光谱,其根本原因在于玻尔的原子模型是建立在牛顿的经典力学理 论基础上的。它的假设是把原子描绘成一个太阳系,认为电子在核外运动就犹如 行星围绕着太阳转一样, 会遵循经典力学的运动规律,但实际上电子这样微小 运动速度又极快的粒子在极小的原子体积内运动,是根本不遵循经典力学的运 规律的。玻尔理论的缺陷,促使人们去研究和建立能描述电子内运动规律的量子 力学原子模型。 52原子结构的近代概念 1g26在奥地利科学家薛定兽E Schr0di ,18871961.图5.2)建立起描 原 规律的 有称波动力 学)理论。人们利用 一位树季理论研究愿子结的,逐步形成了原子结构的近代概老 等) 字 5-2-1电子的波、粒二象性 本世纪初人们己经发现,光不仅有微粒的性质,而且有波动的性质,即具有 波粒二象性。前面已经提及,原子中的电子是一种有确定体积(直径一般为105m) 和质量(9.1091×103kg)的粒子。因此,电子具有粒子性在此无需论证,而且这 点也早为玻尔等人所认识。问题是电子运动是香也像光子二样,表现出波动的性 1927年美国物理学家戴维逊(D.J.Davisson)等通过电子衍射实验证明了电 子运动是确实具有波动性:如图53所示,当高速运动的电子束穿过晶体光栅投 射到感光底片上时,得到的不是一个感光点,而是明暗相间的衍射环纹,与光的 衍射图相似。 后来还相继发现质子、中子等粒子均能产生衍射现象,具有宏观物体难以表 现出来的波动性,而这一特点恰是经典力学所没有认识到的。 5-2-2概率
(3) 基态与激发态 在正常状态下,电子尽可能处于离核较近、能量较低的轨道上,这时原子所 处的状态称为基态。在高温火焰下,电火花或电弧作用下,基态原子中的电子因 获得能量,能跃迁到离核较远、能量较高的空轨道上去运动,这时原子所处的状 态称为激发态。n → ∞ 时,电子所处的轨道能量定为零,意味着电子被激发到 这样的能级时,由于获得足够大的能量,可以完全摆脱核势能场的束缚而电离。 因此,离核越近的轨道,能级越低,势能值越负。 3. 玻尔原子模型的应用范围与局限性 玻尔原子模型成功的解释了氢原子和类氢原子(如 He+ , Li2+,Be3+)的光谱现 象。时至今日,玻尔提出的关于原子中轨道能级的概念,仍然有用。但是玻尔理 论有着严重的局限性,它只能解释单电子原子(或离子)光谱的一般现象,不能解 释多电子原子光谱,其根本原因在于玻尔的原子模型是建立在牛顿的经典力学理 论基础上的。它的假设是把原子描绘成一个太阳系,认为电子在核外运动就犹如 行星围绕着太阳转一样,会遵循经典力学的运动规律,但实际上电子这样微小、 运动速度又极快的粒子在极小的原子体积内运动,是根本不遵循经典力学的运动 规律的。玻尔理论的缺陷,促使人们去研究和建立能描述电子内运动规律的量子 力学原子模型。 5-2 原子结构的近代概念 1926 年奥地利科学家薛定谔(E.Schrodinger,1887~1961,图 5-2),建立起描述 微观粒子(如原子、电子等)运动规律的量子力学(有称波动力学)理论。人们利用 量子力学理论研究原子结构,逐步形成了原子结构的近代概念。 5-2-1 电子的波、粒二象性 本世纪初人们已经发现,光不仅有微粒的性质,而且有波动的性质,即具有 波粒二象性。前面已经提及,原子中的电子是一种有确定体积(直径一般为 10-15m) 和质量(9.1091×10-31kg)的粒子。因此,电子具有粒子性在此无需论证,而且这一 点也早为玻尔等人所认识。问题是电子运动是否也像光子一样,表现出波动的性 质。 1927 年美国物理学家戴维逊(D. J. Davisson)等通过电子衍射实验证明了电 子运动是确实具有波动性:如图 5-3 所示,当高速运动的电子束穿过晶体光栅投 射到感光底片上时,得到的不是一个感光点,而是明暗相间的衍射环纹,与光的 衍射图相似。 后来还相继发现质子、中子等粒子均能产生衍射现象,具有宏观物体难以表 现出来的波动性,而这一特点恰是经典力学所没有认识到的。 5-2-2 概率

若用慢射电子枪(可控制射出电子数的电子发射装置)取代电子束进行类似 图5-3所示的实验,结果发现,每个电子在感光底片上弹着的位置是无法预料的 没有固定轨道的:但是当单个的电 断的发射以后 在感光后 运动得到明暗相间的衍射环纹,这说明电子运动是有想律的 无疑衍射强度大,说明电子出现的机会多,亦即概率大:暗环纹处则正好相反。 量子力学队为,原子中个别电子运动的轨迹是无法确定的,亦即没有确定的 轨道,这一点是与经典力学有原则的差别。但是原子中电子在原子核外的分布还 是有规律的:核外空间某些区域电子出现的概率较大,而另一些电子出现的概率 较小。电子在原子核外空间某处单位体积内出现的概率称为概率密度 5-2-3原子轨道 1.波函数 1926年薛定谔根据波、粒二象性的概念提出了一个描述微观粒子运动的基本 方程一薛定谔波动方程。这个方程是一个二阶段偏微分方程,它的形式如下: 胶++正 2(.门=0 式中g叫做波函数,h为普朗克常数,m为微粒的质量,x,y,:为微粒的空间 标 对氢原子体系来说,”是描述氢核外电子运动状态的数学表达式,是空间坐 标x,少,:的函数x,小E为氢原子的总能量:V为电子的势能(亦即核 对电子的吸引能):m为电子的质量。解一个体系(例如氢原子体系)的薛定谔方程, 一般可以得到一系列的波函数Ψ1s,2s,.4和相应的一系列能量值E1s, ,E.。方程式的每一个合理的解4,就代表体系中电子的一种可能的运 动状态。例如基态氢原子中电子所处的能态: 1 官n E1=-2.179×108J 式中r为电子离原子核的距离,ao被称为玻尔半径“(53pm)π为圆周率,e为自然 对数的底数。 可见在量子力学中是用波函数和与其对应的能量来描述微观粒子运动状态 的。 原子中电子的波函数”既然是描述电子运动的数学表示式,而且又是空间 坐标的函数,其空间图像可以形象的理解为电子运动的空间范围,俗称“原子轨 道”。 这里需要特别提醒注意:此处所指的原子轨道与玻尔原子模型所指的原子轨 道截然不同。前 者指电 在原子核外运动的某个 间范围 后者是指 核外电 子运动的某个确定的圆形轨道。有时为了避免与经典力学中的玻尔轨道相混淆
若用慢射电子枪(可控制射出电子数的电子发射装置)取代电子束进行类似 图 5-3 所示的实验,结果发现,每个电子在感光底片上弹着的位置是无法预料的, 说明电子运动是没有固定轨道的;但是当单个的电子不断的发射以后,在感光底 片上仍然可以得到明暗相间的衍射环纹,这说明电子运动是有规律的。亮环纹处 无疑衍射强度大,说明电子出现的机会多,亦即概率大;暗环纹处则正好相反。 量子力学认为,原子中个别电子运动的轨迹是无法确定的,亦即没有确定的 轨道,这一点是与经典力学有原则的差别。但是原子中电子在原子核外的分布还 是有规律的:核外空间某些区域电子出现的概率较大,而另一些电子出现的概率 较小。电子在原子核外空间某处单位体积内出现的概率称为概率密度。 5-2-3 原子轨道 1. 波函数 1926 年薛定谔根据波、粒二象性的概念提出了一个描述微观粒子运动的基本 方程 ──薛定谔波动方程。这个方程是一个二阶段偏微分方程,它的形式如下: 式中 ψ 叫做波函数, h 为普朗克常数,m 为微粒的质量,x,y,z 为微粒的空间 坐标。 对氢原子体系来说,ψ是描述氢核外电子运动状态的数学表达式,是空间坐 标 x,y,z 的函数 ψ=f(x,y,z);E 为氢原子的总能量;V 为电子的势能(亦即核 对电子的吸引能);m 为电子的质量。解一个体系(例如氢原子体系)的薛定谔方程, 一般可以得到一系列的波函数 ψ1s,ψ2s,ψ2px,.ψi .和相应的一系列能量值 E1s, E2s,E2px,.Ei.。方程式的每一个合理的解 ψi就代表体系中电子的一种可能的运 动状态。例如基态氢原子中电子所处的能态: E1s=-2.179×10-18J 式中 r 为电子离原子核的距离,a0被称为玻尔半径① (53pm),π为圆周率,e 为自然 对数的底数。 可见在量子力学中是用波函数和与其对应的能量来描述微观粒子运动状态 的。 原子中电子的波函数 ψ既然是描述电子运动的数学表示式,而且又是空间 坐标的函数,其空间图像可以形象的理解为电子运动的空间范围,俗称“原子轨 道”。 这里需要特别提醒注意:此处所指的原子轨道与玻尔原子模型所指的原子轨 道截然不同。前者指电子在原子核外运动的某个空间范围,后者是指原子核外电 子运动的某个确定的圆形轨道。有时为了避免与经典力学中的玻尔轨道相混淆

又称为原子轨函(原子轨道函数之意),亦即波函数的空间图像就是原子轨道,原 子轨道的表示式就是波函数。为此,波函数与原子轨道常作同意语混用。 2.原子轨道的角度分布图 将波函数Ψ的角度分布部分(Y)作图,所得的图像就称为原子轨道的角度 分布图(见图5-4),如文字教材中的图5-4实线部分所示。 5-2-4电子云 1.概率密度 在光的波动方程中,代表电磁波的电磁场强度。由于 光的跟度:光子数目 (体玛 光子密度 而光的强度又与电磁场强度y)的绝对值平方成正比: 光的品府oxw小 所以,光子密度是与2成正比的。 同理, 在原子核外某处空间,电子出现的 率密度()也是和电子波在该处的强度()的绝对值平方成正比的: 但在研究时,有实际意义的只是它在空间各处的相对密度,而不是其绝对 值本身,故作图时可不考虑P与p之间的比例常数,因而电子在原子中核外某 处出现的概率密度可直接用来表示。 为了形象地表示核外电子运动的概率分布情况,化学上惯用小黑点分布的疏 密表示电子出现概率密度的相对大小。小黑点较密的地方,表示概率密度较大 单位体积内电子出现的机会多。用这种方法米描述电子在核外出现的概率密度分 布所得的空间图像称为电子云。 既然以小黑点的疏密来表示概率密度大小所得的图像称为电子云,概率密度 又可以直接用财来表示 ,那么若以作图, 应得到电子云的近似图像。将w 的角度分布部分T)作图, 所得的图像就称为电子云角度分布图。电子 云的角度 分布面图与相应的原子轨道角度分布剖面图基本相似,但有两点不同: ()原子轨道角度分布图带有正、负号,而电子云角度分布图均为正值(习惯 不标出正号片 (2)电子云角度分布图比原子轨道角度分布图要瘦”些,这是因为Y值一般 是小于1的,所以值就更小些 从以上介绍可以看出:原子轨道和电子云的空间图像既不是通过实验、更不 是直接观察到的,而是根据量子力学计算得到的数据绘制出来的。 52-5量子数
又称为原子轨函(原子轨道函数之意),亦即波函数的空间图像就是原子轨道,原 子轨道的表示式就是波函数。为此,波函数与原子轨道常作同意语混用。 2. 原子轨道的角度分布图 将波函数 ψ的角度分布部分(Y)作图,所得的图像就称为原子轨道的角度 分布图(见图 5-4),如文字教材中的 图 5-4 实线部分所示。 5-2-4 电子云 1.概率密度 在光的波动方程中,ψ代表电磁波的电磁场强度。由于 而光的强度又与电磁场强度(ψ)的绝对值平方成正比: 光的强度 ∝ |ψ| 2 所以,光子密度是与|ψ| 2 成正比的。同理,在原子核外某处空间,电子出现的概 率密度(ρ)也是和电子波在该处的强度(ψ)的绝对值平方成正比的: ρ∝|ψ| 2 但在研究 ρ时,有实际意义的只是它在空间各处的相对密度,而不是其绝对 值本身,故作图时可不考虑 ρ与|ψ| 2之间的比例常数,因而电子在原子中核外某 处出现的概率密度可直接用|ψ| 2来表示。 为了形象地表示核外电子运动的概率分布情况,化学上惯用小黑点分布的疏 密表示电子出现概率密度的相对大小。小黑点较密的地方,表示概率密度较大, 单位体积内电子出现的机会多。用这种方法来描述电子在核外出现的概率密度分 布所得的空间图像称为电子云。 既然以小黑点的疏密来表示概率密度大小所得的图像称为电子云,概率密度 又可以直接用|ψ| 2来表示,那么若以|ψ| 2作图,应得到电子云的近似图像。将|ψ| 2 的角度分布部分(|Y| 2 )作图,所得的图像就称为电子云角度分布图。电子云的角度 分布剖面图与相应的原子轨道角度分布剖面图基本相似,但有两点不同: (1) 原子轨道角度分布图带有正、负号,而电子云角度分布图均为正值(习惯 不标出正号); (2) 电子云角度分布图比原子轨道角度分布图要“瘦”些,这是因为 Y 值一般 是小于 1 的,所以|Y| 2值就更小些。 从以上介绍可以看出:原子轨道和电子云的空间图像既不是通过实验、更不 是直接观察到的,而是根据量子力学计算得到的数据绘制出来的。 5-2-5 量子数