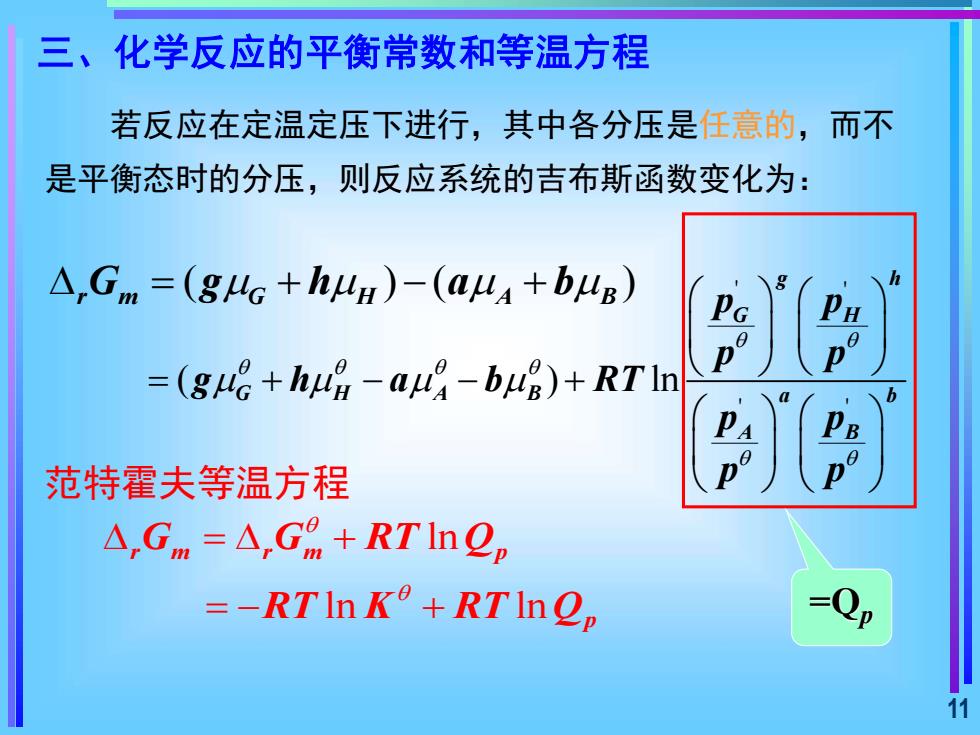
三、化学反应的平衡常数和等温方程 若反应在定温定压下进行,其中各分压是任意的,而不 是平衡态时的分压,则反应系统的吉布斯函数变化为: △,Gm=(gHG+h4H)-(a4A+b4B) h =(g哈+hug-a-bg)+RTln p 范特霍夫等温方程 △,Gm=A,G%+RTln0, =-RTIn K°+RTInOp 11
11 若反应在定温定压下进行,其中各分压是任意的,而不 是平衡态时的分压,则反应系统的吉布斯函数变化为: ( ) ( ) = + − + r m G H A B G g h a b ' ' ' ' ( ) ln g h G H G H A B a b A B p p p p g h a b RT p p p p = + − − + ln ln ln r m r m p p G G RT Q RT K RT Q = + = − + =Qp 范特霍夫等温方程 三、化学反应的平衡常数和等温方程

三、化学反应的平衡常数和等温方程 说明:(1)式中p指平衡分压,PB指任意状态时的分压;K是 标准平衡常数,Q,不是平衡常数,称为“分压商”。 (2)推广到任意化学反应,只需用a代替pp0 △,Gm=△,Gm+RTln2。 活度商 夏(片=° (a儿,an出 a,as月, m理想气体,a表示比值pBpd m高压实际气体,a表示比值fp0 r理想液态混合物,a表示浓度xB 12
12 说明:(1)式中pB指平衡分压,pB ’指任意状态时的分压; Kθ是 标准平衡常数,Qp不是平衡常数,称为“分压商”。 (2)推广到任意化学反应,只需用aB代替pB/pθ ln r m r m a G G RT Q = + 活度商 ( ) B B eq B a K = ( ) ( ) ( ) ( ) b B eq a A eq h H eq g G eq a a a a = B B a B a Q = ☞理想气体, aB表示比值pB/pθ ☞高压实际气体, aB表示比值fB/pθ ☞理想液态混合物, aB表示浓度xB 三、化学反应的平衡常数和等温方程

三、化学反应的平衡常数和等温方程 (3)可利用范特霍夫等温方程判别化学反应的方向和限度。 △,Gm=△,G%+RTInO. =-RTIn K+RTln2。 r当Q。<K时,4,Gm<0,反应正向自发 r当Q。>K阳时,4,Gm>0,反应逆向自发 m当Q。=K阳时,4,Gnm=0,反应达平衡 13
13 (3)可利用范特霍夫等温方程判别化学反应的方向和限度。 ln ln ln = + = − + r m r m a a G G RT Q RT K RT Q ☞当Qa < Kθ时,ΔrGm < 0,反应正向自发 ☞当Qa > Kθ时,ΔrGm > 0,反应逆向自发 ☞当Qa = Kθ时,ΔrGm = 0,反应达平衡 三、化学反应的平衡常数和等温方程

§4.2反应的标准吉布斯自由能变化4,Gme 一、4,Gm和4,Gm⊙的关系 二、标准生成吉布斯自由能4Gm9 三、反应的4,G,me和K⊙的求算 14
14 §4.2 反应的标准吉布斯自由能变化rGm 一、rGm和rGm 的关系 二、标准生成吉布斯自由能 fGm 三、反应的rGm 和K 的求算

一、4,Gm和4,Gm⊙的关系 △,Gm=△,G9+RTln2. 1 A,Gme=Eviui: ()1pμ一定,4,Gme是一常数 △,Gnm-ΣVsB: ()p’△,Gnm不是常数,与Qn有关 24,Gm可指示反应自发进行的方向; 4,Gme即Ke可指示反应的限度。 15
15 一、rGm和rGm 的关系 r Gm r Gm RT Qa = + ln 1 rGm =ii : ( )T,p 一定,rGm 是一常数 rGm =BB : ( )T,p,rGm不是常数,与Qa有关 2 rGm可指示反应自发进行的方向; rGm 即K可指示反应的限度