
(4)写出下列各化合物一硝化的主要产物。 NHCOCH CH: 【思路】(1)先考虑甲基环己烷分子中有几类不等价的氢原子,才能写出所有一溴代产物:再按CH健 均裂的反应活性,即生成的自由基中间体稳定性判断产物的得率:至于取代环己烷的构象,一定是:键上取代基最 多、体积最大的基团在键的椅式构象更稳定。(2)因为苯环取代反应是离子型亲电取代,在反应决速步靡中是亲 电试剂进攻苯环,苯环上电子云密度越大,反应活性就越大,这是确定苯环上已有基团对苯环取代反应活性影响的 切入点:接下来要考毖的问愿就是如何判断苯坏上已有基团是致活基还是致钝基,其致活作用或致钝作用是强还是 弱。(3)尽管在题目给定的条件下化合物发生的是双键的加成反应,而不是米环的取代反应,但这两类反应的共同 点都是亲电试剂进攻反应物,所以与苯环亲电取代反应类似,必须考忠双键碳原子上所连基团对键电子云密度的 影响,而这种影响又是通过苯环上乙烯基对位的取代基施加给π健的,所以既要运用第三章解答此类问题的思路, 又要结合本章取代基的定位效应,才能做出正确判断。(4)第一个化合物要按照两个取代基的定位效应米判断:第 二个化合物属于酯类化合物,两个苯环虽然都与酯起相连,但分别与两个苯环直接相连的原子或基团的定位效应不 同,因此应该先判断硝化反应发生在哪个苯环上,再确定进入的位置:第三个化合物有一个恭环,柑当于存在两个 苯环,解题思路类似于第二个化合物 【解析】按上述思跻解析如下: (1)甲基环己烷分子中有5类不等价的氢原子,所以可写出5种一溴代产物的构造式,其中只有一个3”H 产率最高的应当是31被取代的产物:产物】分子中的澳甲基和产物Ⅱ分子中的甲基在空间所占的体积分别比连在 同一个碳上的氢原子和澳原子大,所以澳甲基和甲基在©铠的构象稳定。 6÷66心68 得率最高 (2)先根据苯环上已有取代基是致活基还是致钝基将题目所给的化合物分组:因为酚羟基和甲基是致活基、 氯和硝基是致纯基,所以这5个化合物可分为3组,苯酚和甲苯发生苯环取代反应的活性大于苯,氯苯和硝基苯的 反应活性小于苯:然后分别比较酚羟基和甲基致活作用、氯和硝基致钝作用的强弱:酚羟基致活作用大于甲基,硝 基的致纯作用大于氯。另外,4个取代基中只有硝基为间位定位基,其余3个都是邻对位定位基。由此得出这些化 合物发生苯环取代反应的活性顺序及一硝化反应的主要位置:
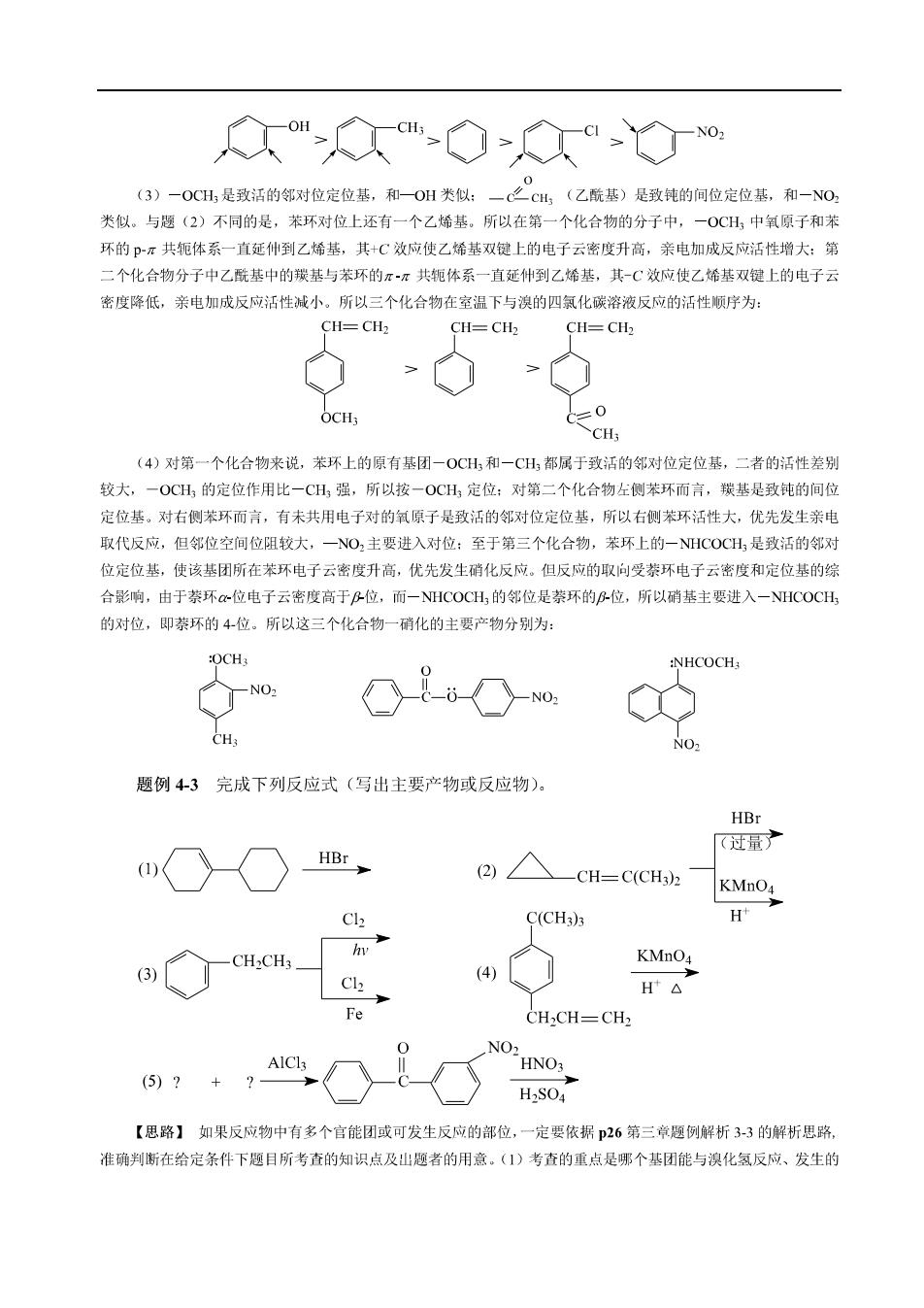
Qm-Q◇≥a◇o 3 一OCH,是致活的邻对位定位基,和OH类似:一之H,(乙酰基)是致钝的间位定位基,和一N0, 类似。与翅(2)不同的是,苯环对位上还有一个乙烯基。所以在第一个化合物的分子中,一OCH,中氧原子和养 坏的Px共轭体系一直延仲到乙烯基,其+C效应使乙烯基双健上的电子云密度升高,亲电加成反应活性增大:第 二个化合物分子中乙酰基中的機基与苯环的π~共轭体系一直延仲到乙烯基,其-C效应使乙烯基双键上的电子云 密度降低,亲电加成反应活性减小,所以三个化合物在室温下与溴的四氯化碳溶液反应的活性懒序为: CH=CH2 CH=CH2 CH=CH CH: (4)对第一个化合物来说,苯环上的原有基团一OCH和一CH,都属于致活的邻对位定位基,二者的活性差别 较大,一OCH,的定位作用比一CH,强,所以按一OCH,定位:对第二个化合物左侧苯环而言,颖基是致钝的间位 定位基。对右侧苯环而言,有未共用电子对的氧原子是致活的邻对位定位基,所以右侧苯环活性大,优先发生亲电 取代反应,但邻位空间位阻较大,一NO,主要进入对位:至于第三个化合物,苯环上的一NHCOCH是致活的邻对 位定位基,使该基团所在苯环电子云密度升高,优先发生硝化反应。但反应的取向受环电子云密度和定位基的缘 合影响,由于蔡环a~位电子云密度高于P位,而一NHCOCH,的邻位是萘环的r位,所以硝基主要进入一NHCOCH 的对位,即蔡环的4位。所以这三个化合物一硝化的主要产物分别为: OCH: :NHCOCH No: CH NO2 题例4-3完成下列反应式(写出主要产物或反应物) HBr 过最了 2, —CH=C(CH2 KMnO4 C(CH3)s (4) H Fe CH2CH=CH2 NO HNO3 H2S04 【思路】如果反应物中有多个官能团或可发生反应的部位,一定要依据26第三章题例解析33的解折思路。 准确判断在给定条件下题目所考查的知识点及山翘者的用意。()考查的重点是哪个基团能与溴化氢反应、发生的

是哪类反应:反应是否存在取向问避。(2)第一个反应试剂是溴化氢,应注意“过量”二字,意指两个基团都能反 应,即双锭加成、环丙基开环加成反应:随后还是反应的取向问题:第二个反应试剂是高锰酸钾,双键肯定能被 化,因此该题筑是考查环丙基能否被氧化。(3)同一种反应物,反应条件不同,发生的主要反应往往不一样,所以 有机化学反应一定要注意反应条件:反成试剂都是氯气,究竟在哪个条件下发生苯环氯代或测链氯代反应,是该题 考查的知识点之一:要考查的另一个知识点则是:如果发生苯环侧链氯代反碗,哪类氢原子优先被取代。(4)该题 考查的知识点有两个:其一是单环芳烃的侧链符合什么条件时能被氧化,得到什么产物:其二是如果烯丙基侧链能 被氧化,究竟发生在哪个部位。(5)已知反应物、反应试剂和条件,写出主要产物,这是完成反应式的一种题型: 另一种趣型侧是根据反应产物和条件写出反应物,该题是两种趣型的结合:第二步相对容易判断,是考查硝化反应 发生在哪个苯环以及苯环上的什么位置,属于第一种趣型:第一步是考查用何种方法可制备芳香族酮,属于第二种 题型。 【解析】(1)结构中是否存在环只是一个形式,关健是解读反应的实质并善于分析。首先是环己基不可能 与溴化氢发生开环加成或自由基取代反应:其次是如果没有环己基,环己烯与溴化氢的加成反应只有一种产物,既 然环己基不反应,那么所起到的作用与丙烯分子中的甲基类似,反应的取向符合马氏规则 (2)按上述解析思路写出第一个反应产物并不难,问题是取代环丙烷与澳化氢发生开环加成反应时,为什么 优先在含氢原子最多和最少的碳原子之间开环,而且氢原子优先加到含氢较多的碳原子上?如38解读1,环丙烷 烷基衍生物酸解反应的取向所述,因为该反应的机理与稀烃亲电加成反应类似,H进攻取代环丙烷并生成开链磷 正离子中间体是反应决速步聚,只有按上述规则才能使反应活化能降低,即才能生成稳定性较大的中间体。根据环 烷烃化学性质的解读,第二个反应中环丙基不被高锰酸钾氧化。 (3)苯环的氯代反应是离子型亲电取代,需要L©ws酸三氯化铁的催化,氯原子主要进入乙基的邻对位。 环侧链的氯代反应是自由基取代反应,在光照或高温条件下的一氯代主要发生在:位,这样得到的自由基中间体 中未成对电子所在的碳原子与苯环形成稳定的p-共轭体系,相应C一H键均裂的活性大 (4)如果苯环侧链α-碳原子上没有氢原子,则不被高锰酸钾氧化。如果该化合物不是3苯基丙烯而是丙烯, 被高锰酸钾氧化只能从碳碳双健处断裂,但因为烯丙基有aH,所以还能在苯环与-碳原子之间断裂,生成苯甲酸, :氧化碳和水 (5)第二步硝化反应一定发生在左侧苯环上,且在袋基的间位。这是因为硝基是致纯基,所以右侧苯环反应 活性低:同时基是间位定位基,故硝基进入其间位。至于第一步反应。由于催化剂是三氯化铝,产物又是劳香族 酮,因此应通过苯环的傅克酰基化反应实现。从产物反推: NO: NO2 0 如果苯环上有强致钝基,傅-克反应(烷基化和酰基化)难以发生,因此只有根据思路2选用反应物,才能得 到指定产物 这五个反应的主要产物分别是:

w○○ (2)CH:CHaCHCH2C(CH △c00H+0=cGH, Br Br CH C(CH3)3 o◇ CI CK NO2 COOH NO 6+c 题例44用指定原料和必要的试剂合成下列化合物。 D用甲苯为原料合成0,N-《C一C0OH SO3H (2)以苯为原料合成邻溴甲苯 【思路】在有机合成中常把要合成的最终产物称为目标化合物,往往不可能通过一步反应就得到所要合成的 目标化合物。首先,要结合给定的原料,剖析目标化合物的结构:其次,要从后往前一步一步推理:先分析目标化 合物可由哪一种化合物经过哪一类反应得到,再依次找到每一种反应中间产物,并设法与给定的原料联系起来(这 在有机合成上称为逆合成分析):再次,根据推理结果从前往后用给定的原料,制定合理的合成路线,逐步得到各 个反应中间产物,最终得到目标化合物:最后,用反应流程图表示合成路线,并在箭头上注明反应试剂和反应条件 用指定原料制备一个目标化合物的合成路线可可能有多种,应当尽可能选择反应步魔少、产率高。副反应少,产 物易提纯、操作方法简便安全的合成路线。 【解析】(1)用甲苯为原料合成的目标化合物分子中有一个羧基,显然可通过甲苯的氧化得到.但在目标 化合物分子中,磺酸基和硝基分别处在羧基的邻位和对位,羧基又是致纯的间位定位基,如果先用甲苯直接氧化市 得苯甲酸,磺酸基和硝基进入指定位置的产宰就相当低,所以应当用甲苯通过苯环的硝化或碳化反应将硝基或碳酸 基引入指定位置,接下来要确定的就是先引入硝基还是先引入碳酸基,由于甲基是致的邻对位定位基,所以无论 用哪种合成线似乎都可得到带要的中间产物。但如果先引入磺酸基,则会由于空间位阻(磺酸基体积比硝基大) 而主要得到对位产物,即对甲基苯磺酸,因此应该先硝化再碳化 合成路线的反应流程图如下: CH COOH 浓O分离 一s0H 浓HS0 NO -NO (2)用苯为原料,必须引入甲基和溴。尽管这两个基团哪个先引入,都会得到需要的目标化合物,但仍需要 制定合理的合成路线,以提高产率。由于澳是致钝基,所以应当先通过傅一克烷基化反应引入甲基,制得甲苯。但 溴的空间位阻较大,所以接下来引入溴时主要产物是对溴甲苯。如果能够先在甲基的对位引入一个体积大的基团, 而且该基团与甲基的定位作用一致,这样或能将溴引入甲基的邻位,然后再通过简单的方法把对位上的基团脱去

使可得到目标化合物 合成路线的反应流程图如下: CH 磺酸基空间位阻大,磺化反应又是可逆反应,用甲苯为原料在加热的条件下可将磺酸基引入甲基的对位,且产 率很高。碳酸基是致钝的间位定位基,甲基是致活的邻对位定位基,二者对第三个基团的引入定位作用一致、互相 加强,使中间产物4甲基3-溴苯磺酸的产率很高。最后利用磺化反应的逆反应,在酸性条件下通入水蒸气(或用 稀硫酸并加热),脱去磺酸基,且不会对苯坏上的一CH,和一造成影响。在有机合成中常用此反应保护苯环上取 代基的对位,即所谓“占位”合成法