
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
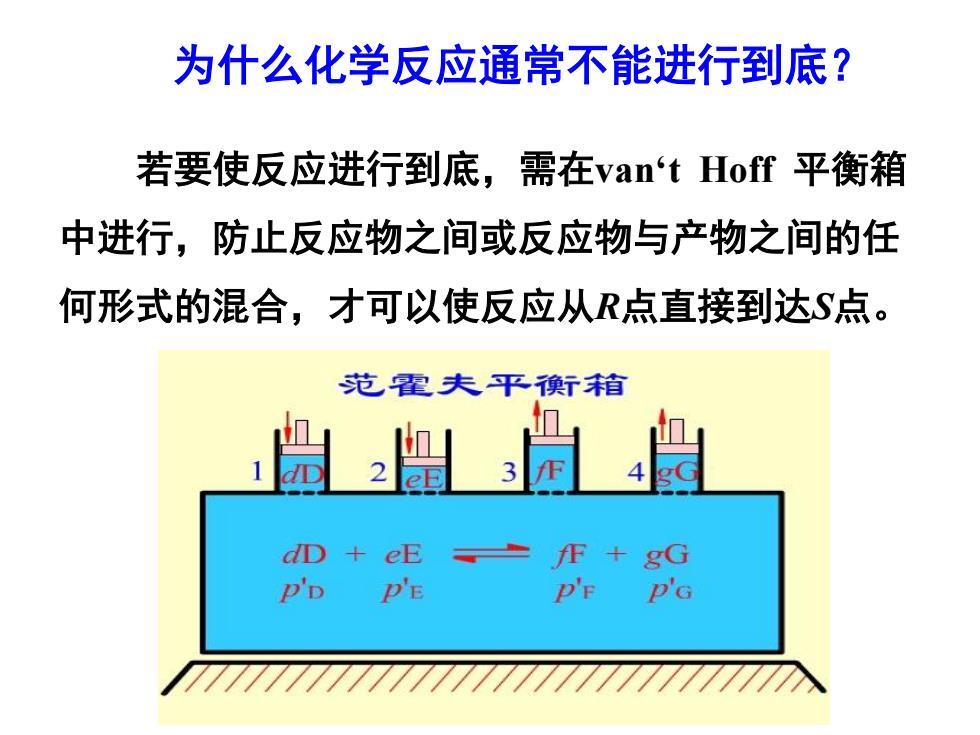
为什么化学反应通常不能进行到底? 若要使反应进行到底,需在van‘t Hoff平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点。 范霍夫平衡舒箱 贵出尚 dD+eEF+gG P'D PE D'F P'G
为什么化学反应通常不能进行到底? 若要使反应进行到底,需在van‘t Hoff 平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点

2.化学反应的亲和势 1922年,比利时热力学专家De donder首先引进 了化学反应亲和势的概念。他定义化学亲和势A为: def A T A=-A,G。=-∑yh 代入基本公式,得 dG=-SdT+Vdp-Adg
2.化学反应的亲和势 1922年,比利时热力学专家De donder首先引进 了化学反应亲和势的概念。他定义化学亲和势A为: def , ( )T p G A − A G = −r m B B B = − d d d d G S T V p A = − + − 代入基本公式,得

化学反应的亲和势 对于一般的化学反应 0=∑B =∑ah=△,Gm=-A A>0 反应正向进行 A<0 反应逆向进行 A= 反应达平衡
化学反应的亲和势 对于一般的化学反应 反应正向进行 反应达平衡 B B 0 B = B B r B m T p, G G A = = = − A> 0 A< 0 反应逆向进行 A= 0

§6.2 化学反应的平衡常数和等温方程式 气相反应的平衡常数一化学反应的等温方程式 液相中反应的平衡常数
§6.2 化学反应的平衡常数和等温方程式 气相反应的平衡常数——化学反应的等温方程式 液相中反应的平衡常数