
化学反应的平衡条件和反应进度ξ的关系 (dGr,p=∑4d5 说明: (1)适用于等温、等压、不作非膨胀功的化学反应; (2)适用于某个反应进度或时刻时反应方向的判断, 此时,需保证各物质的化学势4有定值
化学反应的平衡条件和反应进度 的关系 , B B B (d d G)T p = B B r m T p, B G G = = 说明: (1)适用于等温、等压、不作非膨胀功的化学反应; (2)适用于某个反应进度或时刻时反应方向的判断, 此时,需保证各物质的化学势 B 有定值

判断化学反应的方向与限度 用( G,24,或aGh,作判据都是等效的 (A.Gm).<0 反应自发地向右进行 ∑4<0 (A.Gm)T.p>0 反应自发地向左进行 ∑Yh>0 (A.Gm)T,p=0 反应达到平衡 Σ40
判断化学反应的方向与限度 用 , B r m , 作判据都是等效的 B ( ) , ( ) T p B T p G G 或 r m , ( ) 0 G T p 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行 r m , ( ) 0 G T p = 反应达到平衡 B B B 0 B B B > 0 B B B = 0

判断化学反应的方向与限度 用 判断,这相当于G~5图上曲线的斜率 ,p <0 反应自发向右进行,趋向平衡 8G >0 反应自发向左进行,趋向平衡 og aG =0 )T.P 反应达到平衡
判断化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率 T p, G G ~ , 0 T p G 反应自发向右进行,趋向平衡 , 0 T p G 反应自发向左进行,趋向平衡 , 0 T p G = 反应达到平衡
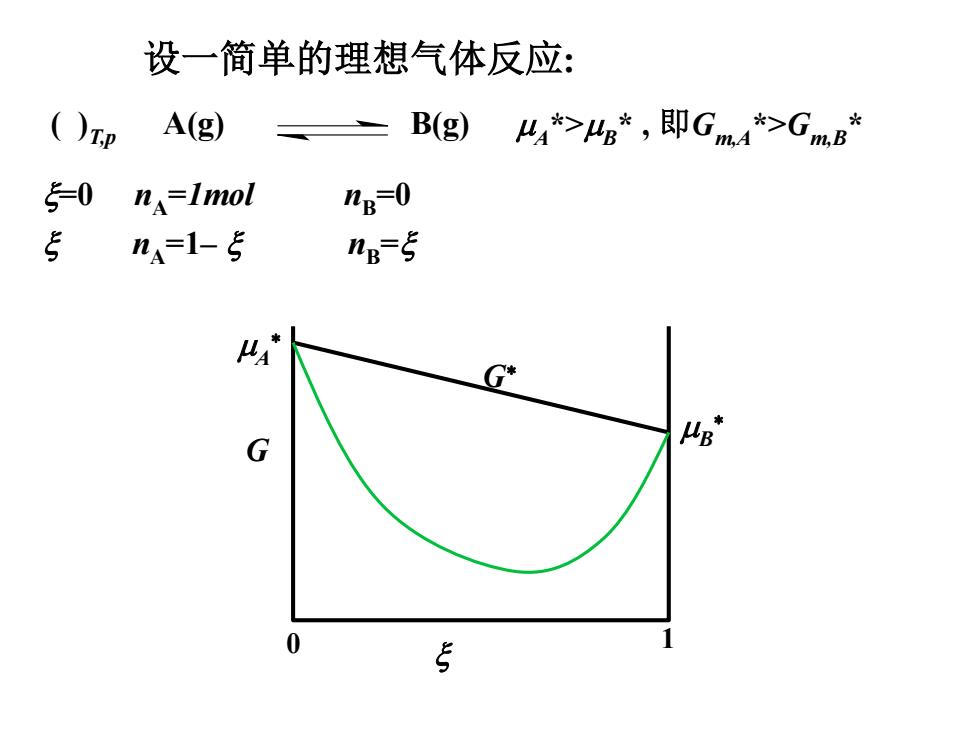
设一简单的理想气体反应: ()p A(g) B(g)4*>4s*,即Gm4*>GmB* 50 nA=Imol nB-0 5 na-1-5 ng-5 G* G 0 5
设一简单的理想气体反应: =0 nA =1mol nB =0 nA =1– nB = ( )T,p A(g) B(g) A *>B * , 即Gm,A*>Gm,B * G G 0 1 A B

为什么化学反应通常不能进行到底? 都向着系统Gibbs自由能降低的方向进行。 0反应正向自发; =0反应达平衡,5=g(限度); >0反应逆向自发。 反应平衡条件: ()np(W0) (△,Gm)z,p=∑YB4B=0 G 59 10
10 反应平衡条件: ( )T,p(Wf =0) 为什么化学反应通常不能进行到底? T,p ξ G , ( ) 0 = = r m T p B B G 都向着系统Gibbs自由能降低的方向进行。 <0 反应正向自发; =0 反应达平衡,= eq(限度); >0 反应逆向自发。 G eq 0 1 A B 0 , T p G 0 , = T p G 0 , T p G