
《物理化学A1》课程教学大纲 课程名称:物理化学A1(Physical Chemistry A1 课程编号:082078 服务专业:化学、化工、应用化学、化学教有 总学时数:48学时讲课学时:48学时 分:3学分 先修课程:高等数学、大学物理、无机化学、有机化学、分析化学 教材:傅献彩,沈文霞等,《物理化学》(第五版)上册。高等教有出版社,2006年 参考书目:1.天津大学编,《物理化学》,高等教育出版社,1992年(第三版) 2.吉林大学等校编,《物理化学》,高等教有出版社,1979、1980年 3.高师院校统编教材(五院校):《物理化学》高等教育出版社,1991年第三版 .PW((E)1 5.Mortimer,Physical Chemistry(2nd),Academic Press,1999. 6.R Mond Chang,Physical Chemistry with Applications to Biological Systems, Macmillan,197,中译本:虞光明,陈飘等译,北京,科学出版社,1986年 7 I Tinoce Ir.K Sauer.I C Wang (Physical Chemistry-Principles and Applications in Bioligical Sciences)Prentice-Hall.1978 课程内容简介: 物理化学是化学学科的一个重要分支,是化学、化学工程、应用化学和化学教育专业的 一门专业基础课。本课程以热力学基本函数为基本背景,阐述化学热力学的基本原理和方法, 介绍化学热力学在多组分体系、相平衡体系和化学平衡体系中的应用:本课程是借助数学、 物理学等基础科学的理论及其提供的实验手段,来研究化学科学中的原理和方法,是一门理 论性非常强的课程,要求具有扎实的数理基础:本课程主要讲授热力学第一定律、热力学第 定律、多组分系统热力学及其在溶液中的应用、相平衡和化学平衡等内容。 一、课程性质、目的和要求 在物理化学讲授中贯彻少而精的原则,通过本课程的学习,使学生系统地掌握物理化学 的基本原理和方法,并初步具有分析和解决实际问题的能力:通过本学科理论的建立和发展 的介绍,培养学生的辨证唯物主义世界观和良好的科学素养。 本课程的学习要求是学习化学热力学的基本知识、原理、方法及其在多组分体系、相平 衡体系和化学平衡体系中的的应用。通过课堂讲授、多媒体教学、自学、作习题、课外讨论 课及考试等教学环节达到本课程的目的。 二、教学内容、要点和课时安排 《物理化学A1》授课课时分配表 章节 讲课习题课讨论课实验其他合计 第一章绪论 2 2 第二章热力学第一定律 10 0 第三章热力学第二定律 10 10
1 《物理化学 A1》课程教学大纲 课程名称:物理化学 A1(Physical Chemistry A1) 课程编号:082078 服务专业:化学、化工、应用化学、化学教育 总学时数:48 学时 讲课学时:48 学时 学 分:3 学分 先修课程:高等数学、大学物理、无机化学、有机化学、分析化学 教 材:傅献彩,沈文霞等,《物理化学》(第五版)上册. 高等教育出版社,2006 年 参考书目:1. 天津大学编,《物理化学》,高等教育出版社,1992 年(第三版) 2. 吉林大学等校编,《物理化学》,高等教育出版社,1979、1980 年 3. 高师院校统编教材(五院校):《物理化学》高等教育出版社,1991 年(第三版) 4. P.W.Atkins,《Physical Chemistry》 (Sixth Ed.), Oxford University Press, 1998. 5. Mortimer,《Physical Chemistry》(2nd), Academic Press, 1999. 6. R. Mond Chang, 《Physical Chemistry with Applications to Biological Systems》, Macmillan, 1977, 中译本:虞光明,陈飘等译,北京,科学出版社,1986 年. 7. I. Tinoce Jr, K. Sauer, J. C . Wang, 《Physical Chemistry –Principles and Applications in Bioligical Sciences》 Prentice-Hall, 1978. 课程内容简介: 物理化学是化学学科的一个重要分支,是化学、化学工程、应用化学和化学教育专业的 一门专业基础课。本课程以热力学基本函数为基本背景,阐述化学热力学的基本原理和方法, 介绍化学热力学在多组分体系、相平衡体系和化学平衡体系中的应用;本课程是借助数学、 物理学等基础科学的理论及其提供的实验手段,来研究化学科学中的原理和方法,是一门理 论性非常强的课程,要求具有扎实的数理基础;本课程主要讲授热力学第一定律、热力学第 二定律、多组分系统热力学及其在溶液中的应用、相平衡和化学平衡等内容。 一、课程性质、目的和要求 在物理化学讲授中贯彻少而精的原则,通过本课程的学习,使学生系统地掌握物理化学 的基本原理和方法,并初步具有分析和解决实际问题的能力;通过本学科理论的建立和发展 的介绍,培养学生的辨证唯物主义世界观和良好的科学素养。 本课程的学习要求是学习化学热力学的基本知识、原理、方法及其在多组分体系、相平 衡体系和化学平衡体系中的的应用。通过课堂讲授、多媒体教学、自学、作习题、课外讨论 课及考试等教学环节达到本课程的目的。 二、教学内容、要点和课时安排 《物理化学 A1》授课课时分配表 章节 讲课 习题课 讨论课 实验 其他 合计 第一章 绪论 2 2 第二章 热力学第一定律 10 10 第三章 热力学第二定律 10 10
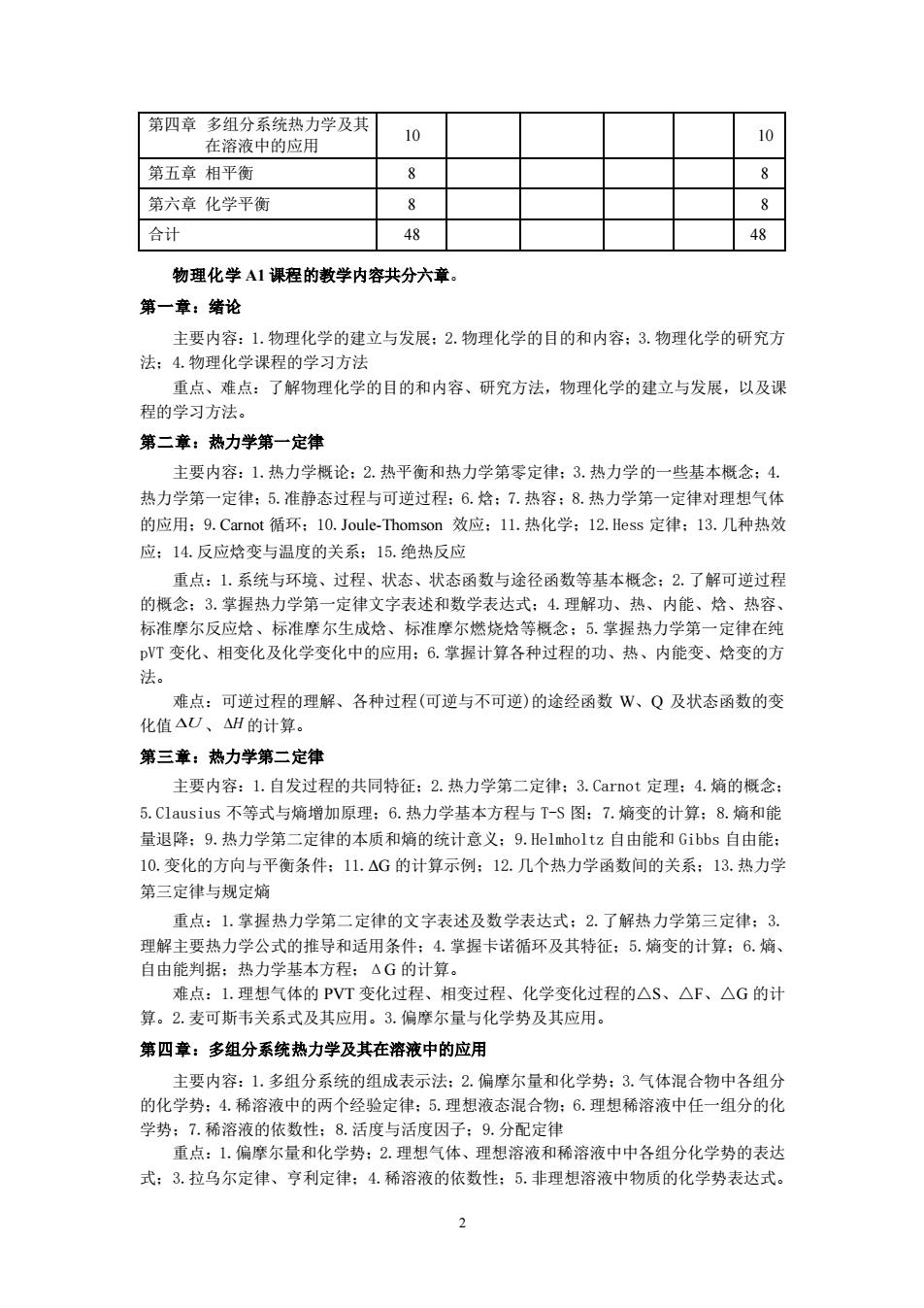
第四章多组分系统热力学及其 在溶液中的应用 10 第五章相平衡 8 8 第六章化学平衡 合计 48 48 物理化学A1课程的教学内容共分六章。 第一章:绪论 主要内容:1.物理化学的建立与发展:2.物理化学的目的和内容:3.物理化学的研究方 法:4物理化学课程的学习方法 重点、难点:了解物理化学的目的和内容、研究方法,物理化学的建立与发展,以及课 程的学习方法。 第二章:热力学第一定律 主要内容:1.热力学概论:2.热平衡和热力学第零定律:3热力学的一些基本概念:4 热力学第一定律:5.准静态过程与可逆过程:6.格:7.热容:8.热力学第一定律对理想气体 的应用:9.Carnot循环:10.Joule-Thomson效应:1L.热化学:12.Hess定律:13.几种热效 应:14.反应格变与温度的关系:15.绝热反应 重点:1,系统与环境、过程、状态、状态函数与途径函数等基本概念:2.了解可逆过程 的概念:3掌握热力学第一定律文字表述和数学表达式:4.理解功、热、内能、格、热容 标准摩尔反应、标准摩尔生成格、标准摩尔燃烧烙等概念:5.掌握热力学第一定律在 VT变化、相变化及化学变化中的应用:6.掌捏计算各种过程的功、热、内能变、格变的方 法。 难点:可逆过程的理解、各种过程(可逆与不可逆)的途经函数W、O及状态函数的变 化值AU、△1的计算。 第三章:热力学第二定律 主要内容:1.自发过程的共同特征:2.热力学第二定律:3.Carnot定理:4.熵的概念 5.C1 ausius不等式与镜增加原理:6.热力学基本方程与T-S图:7.缩变的计算:8.焰和能 量退降:9.热力学第二定律的本质和熵的统计意义:9.le1 nholtz自由能和Gibbs自由能 10.变化的方向与平衡条件:1L.△G的计算示例:12.几个热力学函数间的关系:13.热力学 第三定律与规定境 重点:1.掌握热力学第二定律的文字表述及数学表达式:2.了解热力学第三定律:3. 理解主要热力学公式的推导和适用条件:4.掌握卡诺循环及其特征:5.熵变的计算:6.熵、 自由能判据:热力学基本方程:△G的计算。 难点: 1理相与体的 VT变化过程、相变过稻 、化学变化过程的△S、△F、△G的计 算。2.麦可斯韦关系式及其应用。3.偏摩尔量与化学势及其应用。 第四章:多组分系统热力学及其在溶液中的应用 主要内容:1.多组分系统的组成表示法:2.偏摩尔量和化学势:3.气体混合物中各组分 的化学势:4.稀溶液中的两个 经验定律:5.理想液态混合物:6.理想稀溶液中任一组分的化 学势:7.稀溶液的依数性:8.活度与活度因子:9.分配定律 重点:1.偏摩尔量和化学势:2.理想气体、理想溶液和稀溶液中中各组分化学势的表达 式:3.拉乌尔定律、亨利定律:4.稀溶液的依数性:5.非理想溶液中物质的化学势表达式
2 第四章 多组分系统热力学及其 在溶液中的应用 10 10 第五章 相平衡 8 8 第六章 化学平衡 8 8 合计 48 48 物理化学 A1 课程的教学内容共分六章。 第一章:绪论 主要内容:1.物理化学的建立与发展;2.物理化学的目的和内容;3.物理化学的研究方 法;4.物理化学课程的学习方法 重点、难点:了解物理化学的目的和内容、研究方法,物理化学的建立与发展,以及课 程的学习方法。 第二章:热力学第一定律 主要内容:1.热力学概论;2.热平衡和热力学第零定律;3.热力学的一些基本概念;4. 热力学第一定律;5.准静态过程与可逆过程;6.焓;7.热容;8.热力学第一定律对理想气体 的应用;9.Carnot 循环;10.Joule-Thomson 效应;11.热化学;12.Hess 定律;13.几种热效 应;14.反应焓变与温度的关系;15.绝热反应 重点:1.系统与环境、过程、状态、状态函数与途径函数等基本概念;2.了解可逆过程 的概念;3.掌握热力学第一定律文字表述和数学表达式;4.理解功、热、内能、焓、热容、 标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等概念;5.掌握热力学第一定律在纯 pVT 变化、相变化及化学变化中的应用;6.掌握计算各种过程的功、热、内能变、焓变的方 法。 难点:可逆过程的理解、各种过程(可逆与不可逆)的途经函数 W、Q 及状态函数的变 化值 U 、H 的计算。 第三章:热力学第二定律 主要内容:1.自发过程的共同特征;2.热力学第二定律;3.Carnot 定理;4.熵的概念; 5.Clausius 不等式与熵增加原理;6.热力学基本方程与 T-S 图;7.熵变的计算;8.熵和能 量退降;9.热力学第二定律的本质和熵的统计意义;9.Helmholtz 自由能和 Gibbs 自由能; 10.变化的方向与平衡条件;11.ΔG 的计算示例;12.几个热力学函数间的关系;13.热力学 第三定律与规定熵 重点:1.掌握热力学第二定律的文字表述及数学表达式;2.了解热力学第三定律;3. 理解主要热力学公式的推导和适用条件;4.掌握卡诺循环及其特征;5.熵变的计算;6.熵、 自由能判据;热力学基本方程;ΔG 的计算。 难点:1.理想气体的 PVT 变化过程、相变过程、化学变化过程的△S、△F、△G 的计 算。2.麦可斯韦关系式及其应用。3.偏摩尔量与化学势及其应用。 第四章:多组分系统热力学及其在溶液中的应用 主要内容:1.多组分系统的组成表示法;2.偏摩尔量和化学势;3.气体混合物中各组分 的化学势;4.稀溶液中的两个经验定律;5.理想液态混合物;6.理想稀溶液中任一组分的化 学势;7.稀溶液的依数性;8.活度与活度因子;9.分配定律 重点:1.偏摩尔量和化学势;2.理想气体、理想溶液和稀溶液中中各组分化学势的表达 式;3.拉乌尔定律、亨利定律;4.稀溶液的依数性;5.非理想溶液中物质的化学势表达式

难点:混合气体、(非)理想溶液、稀溶液中各组分的化学势表示法、标准态、的定义 及逸度系数、活度系数的计算。 第五章:相平衡 主要内容:1.多相系统平衡的一般条件:2.相律:3.单组分系统的相平衡:4.理想的二 组分液态混合物:5.杠杆规则:6.蒸馏的基本原理;7.非理想的二组分液态混合物:8.部分 互溶的双液系:9.简单的低共熔二元相图:10.形成化合物的系统:11.液、固相都完全互溶 的相图:12.固态部分互溶的二组分相图:13.区域熔炼:14.三组分系统的相图及其应用 重点:1.相律的意义及其应用:2.水的相图:3.克拉佩龙方程和克劳修斯-克拉佩龙方 程其有关计算:4.完全互溶双液系统的相图:5.杠杆规则的含义及其应用:6.单组分系统及 二组分系统典型相图的特点和应用 难点:1.相律及其应用:2.二组分生成简单的低共熔混合物、生成稳定与不稳定的化合 物、生成固熔体的相图及其应用。 第六章:化学平衡 主要内容:1.化学反应的平衡条件:2.化学反应的平衡常数和等温方程式:3.平衡常数 的表示式:4.复相化学平衡:5.标准摩尔生成Gibbs自由能:6.温度、压力及惰性气体对化 学平衡的影响:7.同时化学平衡:8.反应的耦合:9.近似计算 重点:1.掌握平衡常数的各种表示方法:2.反应方向、限度与△G的关系:3.反应的 标准吉布斯自由能的应用:4.温度对化学平衡的影响:5.理解等温方程和范特霍夫方程的推 导并会应用:6.有关平衡的计算:7.压力及惰性气体对反应平衡的影响。 三、教学方法 本课程的教学,通过课堂讲授、学生自学、演算习题和考核、考试等环节,使学生较系 统地掌握物理化学的基础知识,基本理论和基本技能,是培养学生逻辑思维和空间想象力的 重要课程,以满足后续课及其专业的需要。 四、成绩考核方式 本课程的考核是平时成绩和期终考试成绩相结合,平时成绩的评定包括作业、课堂提问 和考核成绩三部分,平时成绩占课程考核成绩的30%,期终考试为闭卷考试,成绩占课程 考核成绩的70%。 大纲执笔者:周子彦 分管教学负责人:赵增典 编写时间:2006年12月8日 3
3 难点:混合气体、(非)理想溶液、稀溶液中各组分的化学势表示法、标准态、的定义 及逸度系数、活度系数的计算。 第五章:相平衡 主要内容:1.多相系统平衡的一般条件;2.相律;3.单组分系统的相平衡;4.理想的二 组分液态混合物;5.杠杆规则;6.蒸馏的基本原理;7.非理想的二组分液态混合物;8.部分 互溶的双液系;9.简单的低共熔二元相图;10.形成化合物的系统;11.液、固相都完全互溶 的相图;12.固态部分互溶的二组分相图;13.区域熔炼;14.三组分系统的相图及其应用 重点:1.相律的意义及其应用;2.水的相图;3.克拉佩龙方程和克劳修斯-克拉佩龙方 程其有关计算;4.完全互溶双液系统的相图;5.杠杆规则的含义及其应用;6.单组分系统及 二组分系统典型相图的特点和应用 难点:1.相律及其应用;2.二组分生成简单的低共熔混合物、生成稳定与不稳定的化合 物、生成固熔体的相图及其应用。 第六章:化学平衡 主要内容:1.化学反应的平衡条件;2.化学反应的平衡常数和等温方程式;3.平衡常数 的表示式;4.复相化学平衡;5.标准摩尔生成 Gibbs 自由能;6.温度、压力及惰性气体对化 学平衡的影响;7.同时化学平衡;8.反应的耦合;9.近似计算 重点:1.掌握平衡常数的各种表示方法;2.反应方向、限度与 ΔG 的关系;3.反应的 标准吉布斯自由能的应用;4.温度对化学平衡的影响;5.理解等温方程和范特霍夫方程的推 导并会应用;6.有关平衡的计算;7.压力及惰性气体对反应平衡的影响。 三、 教学方法 本课程的教学,通过课堂讲授、学生自学、演算习题和考核、考试等环节,使学生较系 统地掌握物理化学的基础知识,基本理论和基本技能,是培养学生逻辑思维和空间想象力的 重要课程,以满足后续课及其专业的需要。 四、成绩考核方式 本课程的考核是平时成绩和期终考试成绩相结合,平时成绩的评定包括作业、课堂提问 和考核成绩三部分,平时成绩占课程考核成绩的 30%,期终考试为闭卷考试,成绩占课程 考核成绩的 70%。 大纲执笔者:周子彦 分管教学负责人:赵增典 编写时间:2006 年 12 月 8 日