
17.2碳(Carbon) 17.2.1碳的单质 (1)同素异形体 ●结构 碳的三种同素异形体的性质 性质 金刚石 石墨 C60 C原子构型 四面体 三角形平面 近似球面 C-C-C键角/(°) 109.5 120 116(平均 杂化轨道形式 Sp Sp Sp2.28 密度gcm3 3.514 2.266 1.678 C-C键长/pm 154.4 141.8 139.1(6/6;145.5(6/5 富勒烯中以C60最稳定,其笼状结构酷似足球,相当于一个由二十 面体截顶而得的三十二面体.32个面中包括12个五边形面和20个六边形 面,每个五边形均与5个六边形共边,而六边形则将12个五边形彼此隔 开.与石墨相似,C60分子中每个C原子与周围三个C原子形成3个c 键,剩余的轨道和电子共同组成离域π键,可简单地将其表示为每个C 原子与周围3个C原子形成2个单键和1个双键
17.2 碳(Carbon) 同素异形体 ●结构 17.2.1 碳的单质 富勒烯中以C60 最稳定,其笼状结构酷似足球,相当于一个由二十 面体截顶而得的三十二面体. 32个面中包括12个五边形面和20个六边形 面,每个五边形均与5个六边形共边,而六边形则将12个五边形彼此隔 开. 与石墨相似, C60 分子中每个 C 原子与周围三个 C 原子形成 3 个σ 键,剩余的轨道和电子共同组成离域 π 键,可简单地将其表示为每个C 原子与周围3个C原子形成2个单键和1个双键. 性 质 C原子构型 C-C-C键角/(°) 杂化轨道形式 密度/g·cm -3 C-C键长/pm 金刚石 四面体 109.5 Sp 3 3.514 154.4 石 墨 三角形平面 120 Sp 2 2.266 141.8 C60 近似球面 116(平均) Sp 2.28 1.678 139.1(6/6); 145.5(6/5) 碳的三种同素异形体的性质
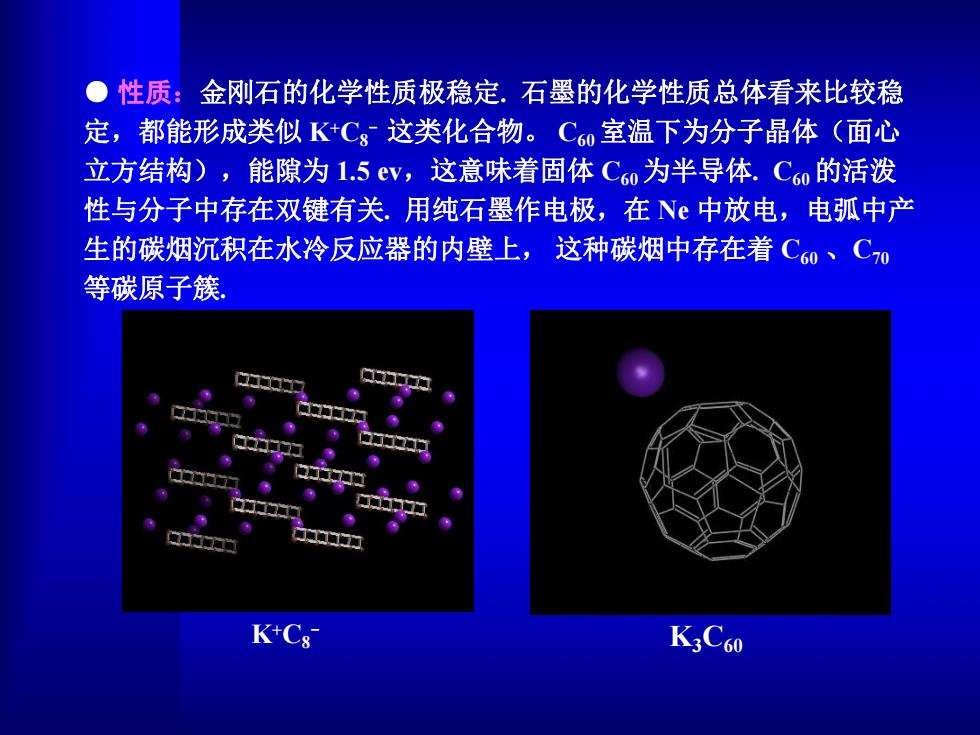
●性质:金刚石的化学性质极稳定.石墨的化学性质总体看来比较稳 定,都能形成类似KC8这类化合物。C60室温下为分子晶体(面心 立方结构),能隙为1.5ev,这意味着固体C60为半导体.C60的活泼 性与分子中存在双键有关.用纯石墨作电极,在N中放电,电弧中产 生的碳烟沉积在水冷反应器的内壁上,这种碳烟中存在着C60、C0 等碳原子簇 K+C8 K3C60
● 性质:金刚石的化学性质极稳定. 石墨的化学性质总体看来比较稳 定,都能形成类似 K+C8- 这类化合物。 C60室温下为分子晶体(面心 立方结构),能隙为 1.5 ev,这意味着固体 C60为半导体. C60的活泼 性与分子中存在双键有关. 用纯石墨作电极,在 Ne 中放电,电弧中产 生的碳烟沉积在水冷反应器的内壁上, 这种碳烟中存在着 C60 、C70 等碳原子簇. K+C8- K3C60
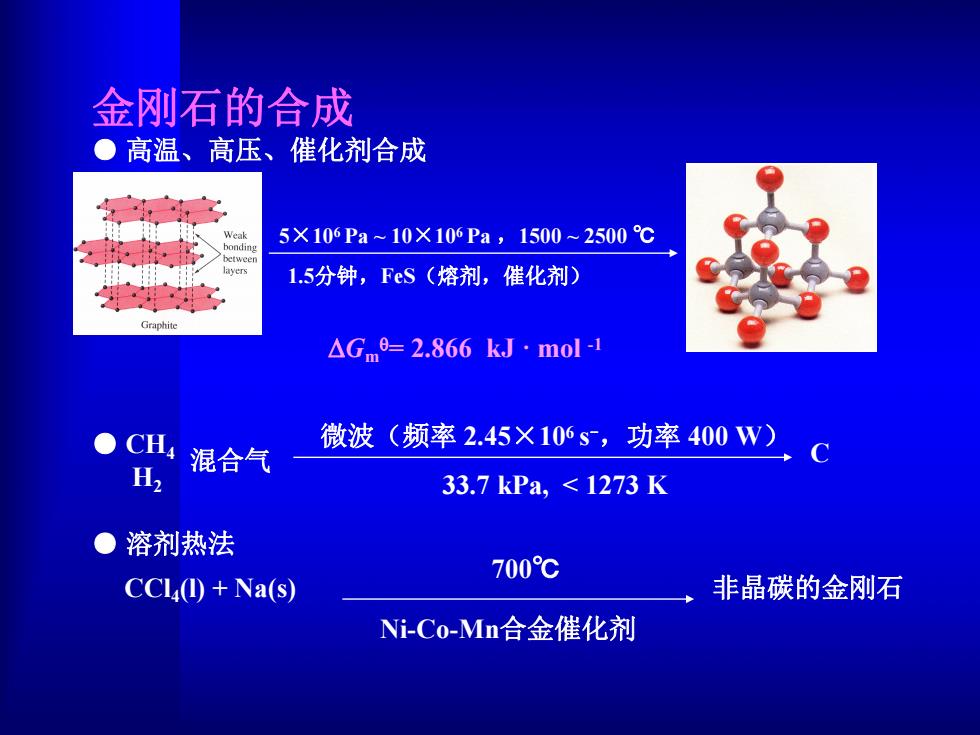
金列石的合成 ●高温、高压、催化剂合成 5×106Pa10X106Pa,1500~2500℃ 1.5分钟,FeS(熔剂,催化剂) Graphite △Gm=2.866kJ·mol-H CH 微波(频率2.45×106s,功率400W) H2 混合气 33.7kPa,≤1273K ●溶剂热法 700℃ CCl①+Na(s) 非晶碳的金刚石 Ni-Co-Mn合金催化剂
● CH4 H2 混合气 C 微波(频率 2.45×106 s -,功率 400 W) 33.7 kPa, < 1273 K ● 溶剂热法 CCl4(l) + Na(s) 非晶碳的金刚石 Ni-Co-Mn合金催化剂 700℃ 金刚石的合成 ● 高温、高压、催化剂合成 1.5分钟,FeS(熔剂,催化剂) 5×10 6 Pa ~ 10×10 6 Pa ,1500 ~ 2500 ℃ DGm q= 2.866 kJ · mol -1

(②)无定形碳(低结晶度碳) ●炭黑(年产超过8×106t,94%用于橡胶制品的填料) ● 活性炭(高比表面积:400~2500m2·g) ● 碳纤维(每架波音-767飞机需用1t碳纤维材料) 碳碳复合材料(隐形飞机) 建议的碳黑的结构 (③)石墨层状间充化合物graphite interstitial compound)
低结晶度碳) ● 炭黑(年产超过 8×10 6 t ,94 % 用于橡胶制品的填料) ● 活性炭(高比表面积:400 ~2500 m2 · g -1) ● 碳纤维(每架波音-767飞机需用 1 t 碳纤维材料) 碳-碳复合材料(隐形飞机) 建议的碳黑的结构
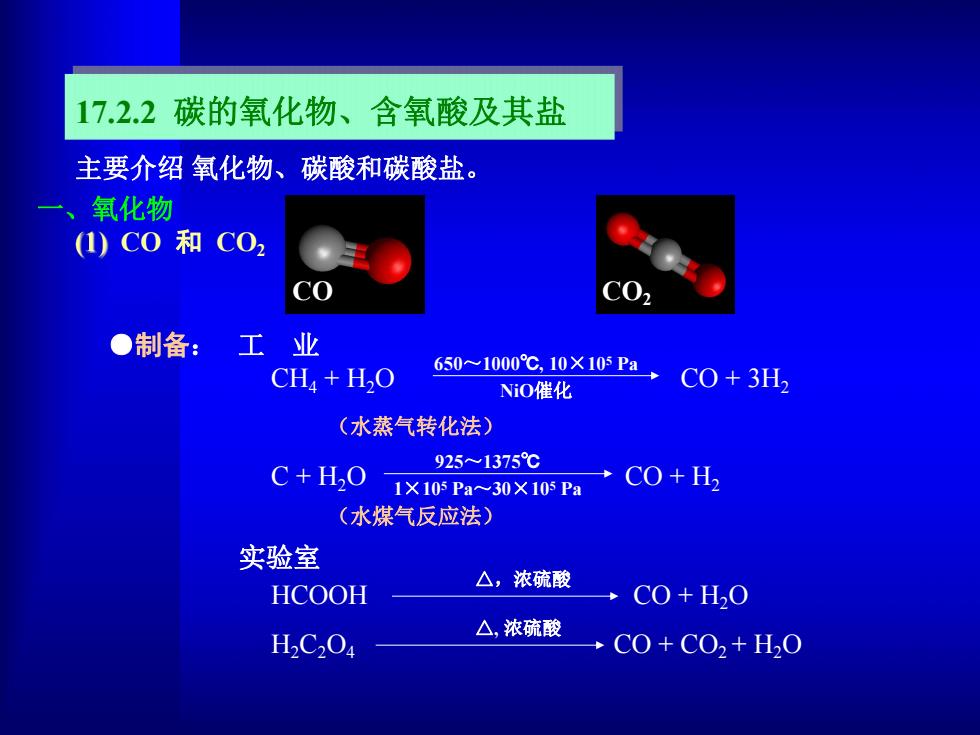
17.2.2碳的氧化物、含氧酸及其盐 主要介绍氧化物、碳酸和碳酸盐。 二、氧化物 (1)C0和C0, C02 ●制备:工 业 CHa H2O 650-1000℃,10×10Pa, NiO催化 CO+3H, (水蒸气转化法) C+H20 9251375℃ 1×105Pa30X105Pa C0+H2 (水煤气反应法) 实验室 △,浓硫酸 HCOOH →C0+HO △,浓硫酸 H2C2Oa →C0+CO2+H0
17.2.2 碳的氧化物、含氧酸及其盐 CO CO2 CO 和 CO2 HCOOH CO + H2O H2C2O4 CO + CO2 + H2O △,浓硫酸 △, 浓硫酸 实验室 主要介绍 氧化物、碳酸和碳酸盐。 CH4 + H2O CO + 3H2 C + H2O CO + H2 650~1000℃, 10×105 Pa NiO催化 925~1375℃ 1×105 Pa~30×105 Pa (水蒸气转化法) (水煤气反应法) ●制备: 工 业 一、氧化物