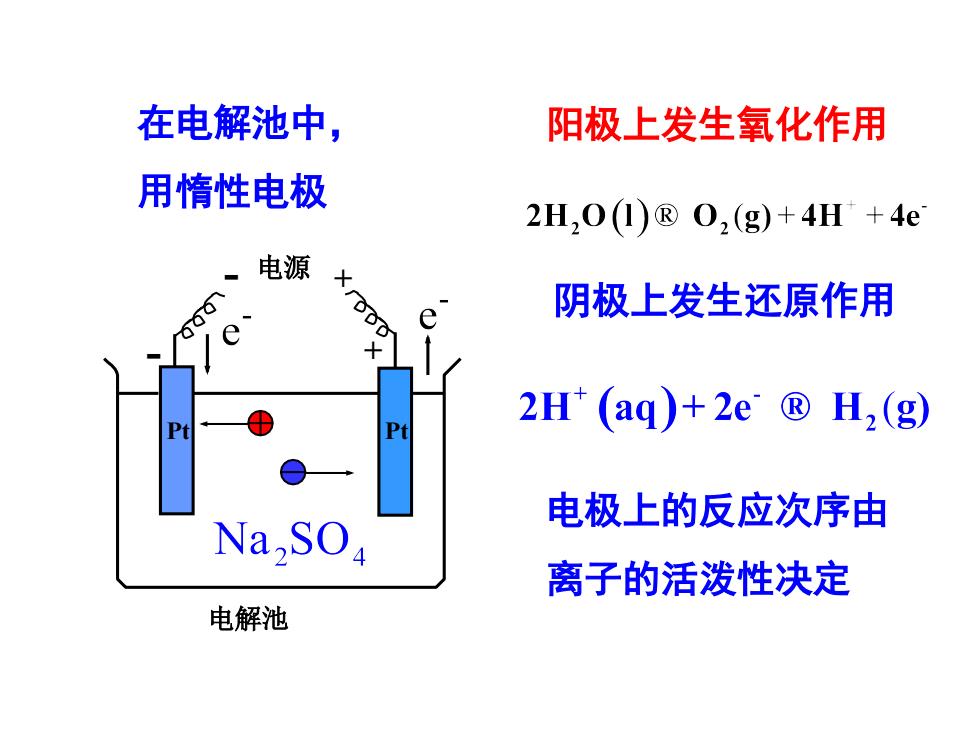
在电解池中, 阳极上发生氧化作用 用惰性电极 2H,0()®02(g)+4H+4e 电源 阴极上发生还原作用 2H(aq)+2e®H2(g) Pt 电极上的反应次序由 Na,SO 离子的活泼性决定 电解池
阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 用惰性电极 - 电源 + 电解池 + Pt - Pt 电极上的反应次序由 离子的活泼性决定

2.Faraday电解定律 Faraday归纳了多次实验结果, 于1833 年总结出了电解定律 (1)在电极界面上发生化学变化的物质的 量与通入的电荷量成正比。 (2)若将几个电解池串联,通入一定的电 荷量后,在各个电解池的电极上发生反应的 物质的量相等。 Ag Ag Cu +e R Cu Au +e® Au(s) 3
2. Faraday电解定律 Faraday 归纳了多次实验结果,于1833 年总结出了电解定律 (1)在电极界面上发生化学变化的物质的 量与通入的电荷量成正比。 (2)若将几个电解池串联,通入一定的电 荷量后,在各个电解池的电极上发生反应的 物质的量相等

Ag +e Ag +e® 2 Au +e® Au(s) 3

人们把在数值上等于1mol元电荷的电量称为 Faraday常数。 已知元电荷电量e为1.6022'1019C F=LXe =6.022'1023mol'1.6022'1019C =96484.6 C xmol >96 500 Cxmol
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。 已知元电荷电量 e 为

如果在电解池中发生如下反应: Mz++z,e-®M(S) 电子得失的计量系数为乙+,欲从阴极上沉积 出1molM(s),即反应进度为1mol时,需通入的电 量为2 Ct-1)=zeL=zF 若反应进度为x时需通入的电量为 C)=3Fx
电子得失的计量系数为 z+,欲从阴极上沉积 出1 mol M(s),即反应进度为1 mol 时,需通入的电 量为 Q 如果在电解池中发生如下反应: 若反应进度为 时需通入的电量为