
- 11 - 表 8-5(Ⅳ) 蛋白质及某些微量营养素的 EARs EARs of protein and some micronutrients 锌 硒 维生素 A维生素 D维生素 B1 维生素 B2 维生素 C 叶酸 Zn Se VA VD VB1 VB2 VC Folic acid 年龄 /岁 Year 蛋白质 Protein /( g/kg) /mg /µg /µgRE* /µg /mg /mg /mg /µgDFE 0- 2.25~1.25 1.5 375 8.88* 0.5- 1.25~1.15 6.7 400 13.8* 1- 7.4 17 300 0.4 0.5 13 320 4- 8.7 20 0.5 0.6 22 320 7- 9.7 26 700 0.5 0.8 39 320 男 M女 F 男 M女 F男 M女 F 11- 13.1 10.8 36 700 0.7 1 320 14- 13.9 11.2 40 1 0.9 1.3 1 13 320 18- 0.92 120 13.2 8.3 41 1.4 1.3 1.2 1 75 320 孕妇 Pregnant women 1.3 1.45 66 520 早期 1st trimester 120 8.3 50 中期 2nd trimester 120 + 5 50 晚期 3rd trimester 120 + 5 50 乳母 lactating mothers 0.18 120 +10 65 1.3 1.4 96 450 50- 0.92 75 320 注:* 0~2.9 岁南方 8.88µg,北方地区为 13.8µg。0~2.9years,8.88µg for north,13.8µg for south china. # RE为视黄醇当量。RE is retinol equivalent (凡表中数字缺如之处表示未制定该参考值)
- 11 - 表 8-5(Ⅳ) 蛋白质及某些微量营养素的 EARs EARs of protein and some micronutrients 锌 硒 维生素 A维生素 D维生素 B1 维生素 B2 维生素 C 叶酸 Zn Se VA VD VB1 VB2 VC Folic acid 年龄 /岁 Year 蛋白质 Protein /( g/kg) /mg /µg /µgRE* /µg /mg /mg /mg /µgDFE 0- 2.25~1.25 1.5 375 8.88* 0.5- 1.25~1.15 6.7 400 13.8* 1- 7.4 17 300 0.4 0.5 13 320 4- 8.7 20 0.5 0.6 22 320 7- 9.7 26 700 0.5 0.8 39 320 男 M女 F 男 M女 F男 M女 F 11- 13.1 10.8 36 700 0.7 1 320 14- 13.9 11.2 40 1 0.9 1.3 1 13 320 18- 0.92 120 13.2 8.3 41 1.4 1.3 1.2 1 75 320 孕妇 Pregnant women 1.3 1.45 66 520 早期 1st trimester 120 8.3 50 中期 2nd trimester 120 + 5 50 晚期 3rd trimester 120 + 5 50 乳母 lactating mothers 0.18 120 +10 65 1.3 1.4 96 450 50- 0.92 75 320 注:* 0~2.9 岁南方 8.88µg,北方地区为 13.8µg。0~2.9years,8.88µg for north,13.8µg for south china. # RE为视黄醇当量。RE is retinol equivalent (凡表中数字缺如之处表示未制定该参考值)

- 13 - 第四节 水溶性维生素 一、抗坏血酸 1.结构和化学性质 维生素C,又名抗坏血酸(Ascorbic Acid),是一种十分重要的生物活性物质。 L-抗坏血酸是高度水溶性化合物,极性很强,具有酸性和强还原性,这些性质 是由于其结构中的 2,3-烯二醇与内酯环羰基共轭所决定的。抗坏血酸主要以 还原型的L-抗坏血酸存在于水果和蔬菜中,在动物组织和动物加工产品中含量 较少。抗坏血酸的双电子氧化和氢离子的解离反应,使之转变为L-脱氢抗坏血 酸(DHAA),DHAA在体内可以完全还原为抗坏血酸,因此,具有与抗坏血酸 相同的生物活性。L-异抗坏血酸和L-抗坏血酸的差别在于C5位上羟基所处的位 置,它们是C5位的光学异构体,L-异抗坏血酸具有与L-抗坏血酸相似的化学性 质,但不具有维生素C的活性。L-异抗坏血酸和L-抗坏血酸在食品中广泛作为抗 氧化剂使用,抑制水果和蔬菜的酶促褐变。自然界存在的抗坏血酸主要是L-异 构体,而D-异构体的含量很少。在食品中使用时,D-异构体不是作为维生素的 用途而是作为抗氧化剂添加到食品中的。L-异构体又有氧化型和还原型两种, L-抗坏血酸和L-脱氢抗坏血酸的异构体,如下所示: C H 2 O H O H O H H C O H O H O C H 2 O H O O O H O H C O H L-抗坏血酸(还原型) L-脱氢抗坏血酸(氧化型) C H 2 O H H O C H O H O H O H O C H 2 O H H O C H O O O H O L-异抗坏血酸 L-抗坏血酸 O H O H C O H H O H 2 C O H O H H O H 2 C H C O H H O O O O D-抗坏血酸 D-脱氢抗坏血酸
- 13 - 第四节 水溶性维生素 一、抗坏血酸 1.结构和化学性质 维生素C,又名抗坏血酸(Ascorbic Acid),是一种十分重要的生物活性物质。 L-抗坏血酸是高度水溶性化合物,极性很强,具有酸性和强还原性,这些性质 是由于其结构中的 2,3-烯二醇与内酯环羰基共轭所决定的。抗坏血酸主要以 还原型的L-抗坏血酸存在于水果和蔬菜中,在动物组织和动物加工产品中含量 较少。抗坏血酸的双电子氧化和氢离子的解离反应,使之转变为L-脱氢抗坏血 酸(DHAA),DHAA在体内可以完全还原为抗坏血酸,因此,具有与抗坏血酸 相同的生物活性。L-异抗坏血酸和L-抗坏血酸的差别在于C5位上羟基所处的位 置,它们是C5位的光学异构体,L-异抗坏血酸具有与L-抗坏血酸相似的化学性 质,但不具有维生素C的活性。L-异抗坏血酸和L-抗坏血酸在食品中广泛作为抗 氧化剂使用,抑制水果和蔬菜的酶促褐变。自然界存在的抗坏血酸主要是L-异 构体,而D-异构体的含量很少。在食品中使用时,D-异构体不是作为维生素的 用途而是作为抗氧化剂添加到食品中的。L-异构体又有氧化型和还原型两种, L-抗坏血酸和L-脱氢抗坏血酸的异构体,如下所示: C H 2 O H O H O H H C O H O H O C H 2 O H O O O H O H C O H L-抗坏血酸(还原型) L-脱氢抗坏血酸(氧化型) C H 2 O H H O C H O H O H O H O C H 2 O H H O C H O O O H O L-异抗坏血酸 L-抗坏血酸 O H O H C O H H O H 2 C O H O H H O H 2 C H C O H H O O O O D-抗坏血酸 D-脱氢抗坏血酸

- 14 - 抗坏血酸在水溶液中,C3位置上的羟基易电离(pKa1=4.04,25℃),其游离酸水 溶液pH为 2.5,C2位置上的羟基较难电离(pka2=11.4)。在不同的pH条件下抗坏 血酸能吸收不同波长的紫外光(见表 8-6)。 表 8-6 抗坏血酸紫外光吸收特征 pH 最大吸收光波长(λmax)nm 2 244 6~10 266 >10 296 2.稳定性 抗坏血酸极易受温度、盐和糖的浓度、pH、氧、酶、金属催化剂特别是Cu2+ 和Fe3+、水分活度、抗坏血酸的初始浓度以及抗坏血酸与脱氢抗坏血酸的比例等 因素的影响而发生降解。由于多种因素影响抗坏血酸的降解,因此,除了反应 历程中的最初产物外,要想确切弄清前体物与产物的关系很是困难的。现在提 出的反应机理和历程都是基于动力学和物理化学测定,以及对游离产物的结构 鉴定所得出的。这些研究大多是在pH低于 2 的模拟体系或高浓度有机酸中进行 的,因此,它们与发生在含有抗坏血酸的特定食品中准确的降解模式不可能完 全相同。 图 8-2 表明了氧和重金属对降解反应途径和产物的影响。在有氧存在下, 抗坏血酸首先降解形成单阴离子(HA- ),可与金属离子和氧形成三元复合物,按 照Buettner的观点,单阴离子HA- 的氧化有多种途径,取决于金属催化剂(Mn+)的 浓度和氧分压的大小。一旦[HA- ]生成后,很快通过单电子氧化途径转变为脱氢 抗坏血酸(A),A的生成速率近似与(HA- ) 、[O2]和[Mn+]的一次方成正比。当金 属催化剂为Cu2+或Fe3+时,速率常数要比自动氧化大几个数量级,其中Cu2+催化 反应速率比Fe3+大 80 倍。即使这些金属离子含量为几个mg/kg,也会引起食品中 维生素C的严重损失。在真实的食品体系中,当金属离子与其它组分(例如氨基 酸)结合或催化其他反应时,可能生成活泼的自由基或活性氧,从而加速抗坏 血酸的氧化。在氧分压低时,非催化氧化反应与氧浓度不成正比(表 8-7),当 氧分压低于 0.4atm时,反应速率几乎趋向稳定,这表明它是一种不同的氧化途 径,可能是由于氢过氧自由基(HO2·)或氢过氧化物直接氧化的结果。与此相反, 在催化反应历程中,当氧分压在 1.0~0.4atm时,反应速率与氧分压成正比, 而在氧分压低于 0.20atm时,氧化速率与溶解氧分压无关。这一反应历程是这 样假定的,即在催化氧化反应中,金属与阴离子形成复合物MHA(n-1)+,此复合物 与氧结合成为金属-氧-配位体三元复合物MHAO2 (n-1)+,后一种复合物含有一个双
- 14 - 抗坏血酸在水溶液中,C3位置上的羟基易电离(pKa1=4.04,25℃),其游离酸水 溶液pH为 2.5,C2位置上的羟基较难电离(pka2=11.4)。在不同的pH条件下抗坏 血酸能吸收不同波长的紫外光(见表 8-6)。 表 8-6 抗坏血酸紫外光吸收特征 pH 最大吸收光波长(λmax)nm 2 244 6~10 266 >10 296 2.稳定性 抗坏血酸极易受温度、盐和糖的浓度、pH、氧、酶、金属催化剂特别是Cu2+ 和Fe3+、水分活度、抗坏血酸的初始浓度以及抗坏血酸与脱氢抗坏血酸的比例等 因素的影响而发生降解。由于多种因素影响抗坏血酸的降解,因此,除了反应 历程中的最初产物外,要想确切弄清前体物与产物的关系很是困难的。现在提 出的反应机理和历程都是基于动力学和物理化学测定,以及对游离产物的结构 鉴定所得出的。这些研究大多是在pH低于 2 的模拟体系或高浓度有机酸中进行 的,因此,它们与发生在含有抗坏血酸的特定食品中准确的降解模式不可能完 全相同。 图 8-2 表明了氧和重金属对降解反应途径和产物的影响。在有氧存在下, 抗坏血酸首先降解形成单阴离子(HA- ),可与金属离子和氧形成三元复合物,按 照Buettner的观点,单阴离子HA- 的氧化有多种途径,取决于金属催化剂(Mn+)的 浓度和氧分压的大小。一旦[HA- ]生成后,很快通过单电子氧化途径转变为脱氢 抗坏血酸(A),A的生成速率近似与(HA- ) 、[O2]和[Mn+]的一次方成正比。当金 属催化剂为Cu2+或Fe3+时,速率常数要比自动氧化大几个数量级,其中Cu2+催化 反应速率比Fe3+大 80 倍。即使这些金属离子含量为几个mg/kg,也会引起食品中 维生素C的严重损失。在真实的食品体系中,当金属离子与其它组分(例如氨基 酸)结合或催化其他反应时,可能生成活泼的自由基或活性氧,从而加速抗坏 血酸的氧化。在氧分压低时,非催化氧化反应与氧浓度不成正比(表 8-7),当 氧分压低于 0.4atm时,反应速率几乎趋向稳定,这表明它是一种不同的氧化途 径,可能是由于氢过氧自由基(HO2·)或氢过氧化物直接氧化的结果。与此相反, 在催化反应历程中,当氧分压在 1.0~0.4atm时,反应速率与氧分压成正比, 而在氧分压低于 0.20atm时,氧化速率与溶解氧分压无关。这一反应历程是这 样假定的,即在催化氧化反应中,金属与阴离子形成复合物MHA(n-1)+,此复合物 与氧结合成为金属-氧-配位体三元复合物MHAO2 (n-1)+,后一种复合物含有一个双

- 15 - 自由基共振结构(图 8-2),能迅速分解为抗坏血酸自由基负离子(AH·)及原来 的金属离子(Mn+)和(HO2·)。抗坏血酸自由基负离子(AH·)迅速与O2反应生成脱 氢抗坏血酸(A)。可见在催化反应中,氧与催化剂的依赖关系是确定反应历程的 关键,而MHAO2 (n-1)+的形成是该氧化反应机理中的限速步骤。在解释糖和其它溶 质对抗坏血酸稳定性的影响时,氧是相当重要的,高浓度的溶质对溶解氧有盐 析效应。 表 8-7 抗坏血酸非催化反应的速度常数(S-1)随氧分压的变化 氧分压(atm) 抗坏血酸负离子的比速 度常数×10-4 氧分压(atm) 抗坏血酸负离子的比速 度常数×10-4 1.00 0.81 0.62 0.40 5.87 4.68 3.52 2.75 0.19 0.10 0.05 2.01 1.93 1.91 在非催化氧化反应历程中,抗坏血酸负离子(HA- )在限速步骤中是直接与分 子氧起化学反应,首先生成自由基负离子(AH·)和氢过氧自由基(HO2·),随后 又迅速生成(A)和H2O。 从上述反应机理可以看出,催化反应和非催化反应历程都有共同的中间体, 用分析产物的方法是很难区分的。由于抗坏血酸易氧化成脱氢抗坏血酸,脱氢 抗坏血酸又易经温和的还原反应再还原成抗坏血酸。而脱氢抗坏血酸的氧化是 不可逆的,尤其在碱性介质中,它可以使内酯水解形成 2,3-二酮基古罗糖酸 (DKG),只是在这时才引起维生素活性的损失。 非催化氧化降解反应速率与pH之间是非线性关系,其两者的相关性曲线呈S 形,抗坏血酸pK1值随着pH值增大而相应的不断增加,当pH大于 6 时,曲线趋向 平坦,速率常数为 6×10-7s -1,说明在中性pH值时,抗坏血酸的氧化降解可以忽 略不计。但是当有痕量的金属离子存在时,将加快抗坏血酸的降解。同时也表 明首先是单阴离子(monoanion)发生氧化。在催化氧化反应中,反应速率与[H+ ] 浓度成反比,这表明H2A和HA- 要争夺O2,HA- 的比速率常数比H2A大 1.5~3.0 数量 级。不同离子状态的抗坏血酸对H+ 的亲合力大小依次为:H2A<HA- <A2-。 在厌氧反应条件下,抗坏血酸的氧化速率在pH为 4 时达到最大,这是因为 25℃时抗坏血酸的pK1=4.04,pH为 2 时降到最小,然后随着酸度的增加而增加, pH低于 2 时的特征反应在食品中毫无意义。但是,pH为 4 时的反应速率最大具 有相当重要的意义。当pH≥8 时由于体系中存在足够的A2-(pK2=11.4,25℃),因此 氧化速率提高。 图 8-2 为推测的厌氧降解路线。Kurata、Sakurai认为,抗坏血酸是经过酮 基互变异构体(H2A-Keto)进行反应的,该互变异构体与其负离子(HA- -Keto)达到 平衡时,HA- -Keto经去内酯化作用生成DKG。尽管在有氧存在下厌氧途径仍能使
- 15 - 自由基共振结构(图 8-2),能迅速分解为抗坏血酸自由基负离子(AH·)及原来 的金属离子(Mn+)和(HO2·)。抗坏血酸自由基负离子(AH·)迅速与O2反应生成脱 氢抗坏血酸(A)。可见在催化反应中,氧与催化剂的依赖关系是确定反应历程的 关键,而MHAO2 (n-1)+的形成是该氧化反应机理中的限速步骤。在解释糖和其它溶 质对抗坏血酸稳定性的影响时,氧是相当重要的,高浓度的溶质对溶解氧有盐 析效应。 表 8-7 抗坏血酸非催化反应的速度常数(S-1)随氧分压的变化 氧分压(atm) 抗坏血酸负离子的比速 度常数×10-4 氧分压(atm) 抗坏血酸负离子的比速 度常数×10-4 1.00 0.81 0.62 0.40 5.87 4.68 3.52 2.75 0.19 0.10 0.05 2.01 1.93 1.91 在非催化氧化反应历程中,抗坏血酸负离子(HA- )在限速步骤中是直接与分 子氧起化学反应,首先生成自由基负离子(AH·)和氢过氧自由基(HO2·),随后 又迅速生成(A)和H2O。 从上述反应机理可以看出,催化反应和非催化反应历程都有共同的中间体, 用分析产物的方法是很难区分的。由于抗坏血酸易氧化成脱氢抗坏血酸,脱氢 抗坏血酸又易经温和的还原反应再还原成抗坏血酸。而脱氢抗坏血酸的氧化是 不可逆的,尤其在碱性介质中,它可以使内酯水解形成 2,3-二酮基古罗糖酸 (DKG),只是在这时才引起维生素活性的损失。 非催化氧化降解反应速率与pH之间是非线性关系,其两者的相关性曲线呈S 形,抗坏血酸pK1值随着pH值增大而相应的不断增加,当pH大于 6 时,曲线趋向 平坦,速率常数为 6×10-7s -1,说明在中性pH值时,抗坏血酸的氧化降解可以忽 略不计。但是当有痕量的金属离子存在时,将加快抗坏血酸的降解。同时也表 明首先是单阴离子(monoanion)发生氧化。在催化氧化反应中,反应速率与[H+ ] 浓度成反比,这表明H2A和HA- 要争夺O2,HA- 的比速率常数比H2A大 1.5~3.0 数量 级。不同离子状态的抗坏血酸对H+ 的亲合力大小依次为:H2A<HA- <A2-。 在厌氧反应条件下,抗坏血酸的氧化速率在pH为 4 时达到最大,这是因为 25℃时抗坏血酸的pK1=4.04,pH为 2 时降到最小,然后随着酸度的增加而增加, pH低于 2 时的特征反应在食品中毫无意义。但是,pH为 4 时的反应速率最大具 有相当重要的意义。当pH≥8 时由于体系中存在足够的A2-(pK2=11.4,25℃),因此 氧化速率提高。 图 8-2 为推测的厌氧降解路线。Kurata、Sakurai认为,抗坏血酸是经过酮 基互变异构体(H2A-Keto)进行反应的,该互变异构体与其负离子(HA- -Keto)达到 平衡时,HA- -Keto经去内酯化作用生成DKG。尽管在有氧存在下厌氧途径仍能使
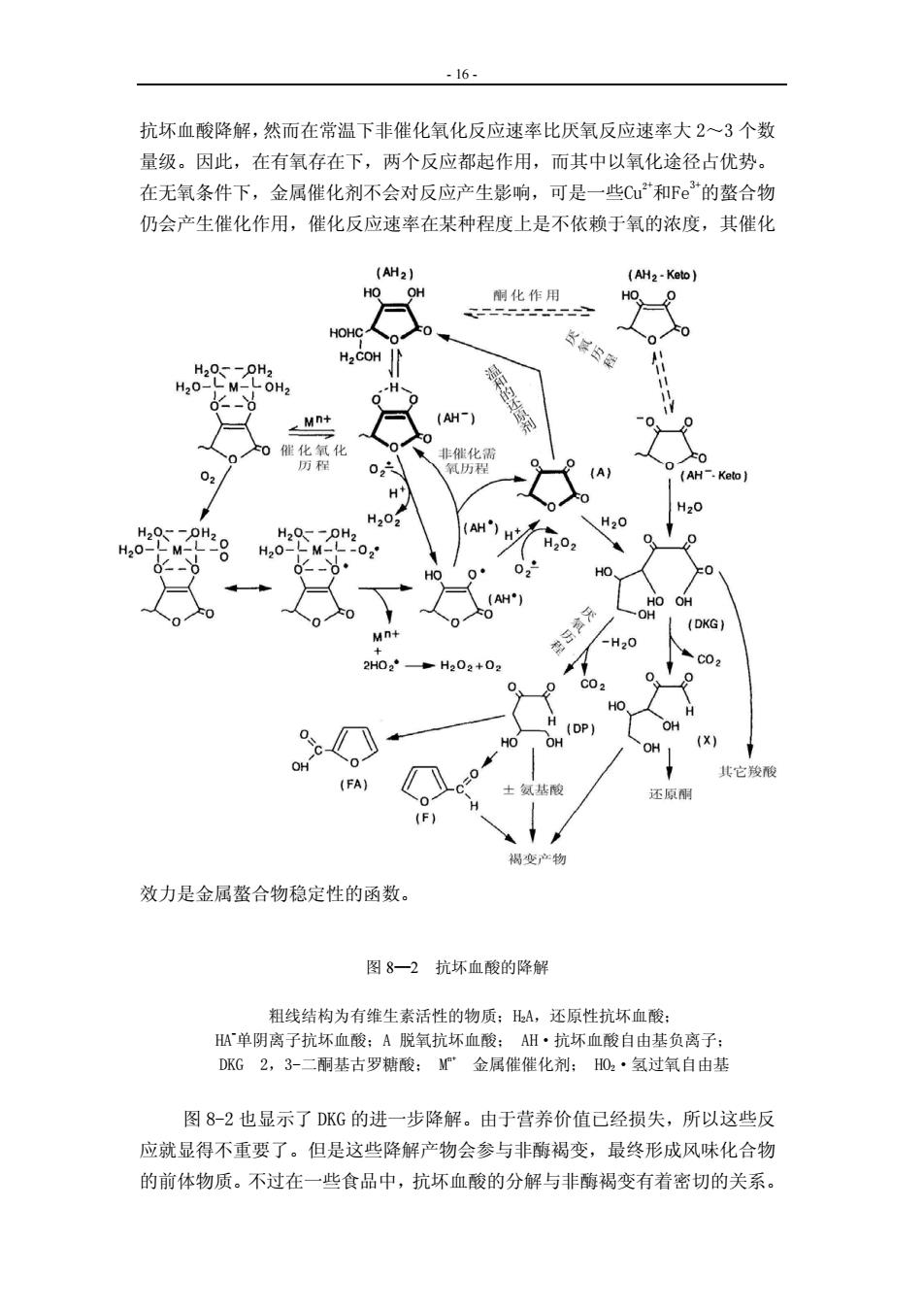
- 16 - 抗坏血酸降解,然而在常温下非催化氧化反应速率比厌氧反应速率大 2~3 个数 量级。因此,在有氧存在下,两个反应都起作用,而其中以氧化途径占优势。 在无氧条件下,金属催化剂不会对反应产生影响,可是一些Cu2+ 和Fe3+的螯合物 仍会产生催化作用,催化反应速率在某种程度上是不依赖于氧的浓度,其催化 效力是金属螯合物稳定性的函数。 图 8—2 抗坏血酸的降解 粗线结构为有维生素活性的物质;H2A,还原性抗坏血酸; HA- 单阴离子抗坏血酸;A 脱氧抗坏血酸; AH·抗坏血酸自由基负离子; DKG 2,3-二酮基古罗糖酸; Mn+ 金属催催化剂; HO2·氢过氧自由基 图 8-2 也显示了 DKG 的进一步降解。由于营养价值已经损失,所以这些反 应就显得不重要了。但是这些降解产物会参与非酶褐变,最终形成风味化合物 的前体物质。不过在一些食品中,抗坏血酸的分解与非酶褐变有着密切的关系
- 16 - 抗坏血酸降解,然而在常温下非催化氧化反应速率比厌氧反应速率大 2~3 个数 量级。因此,在有氧存在下,两个反应都起作用,而其中以氧化途径占优势。 在无氧条件下,金属催化剂不会对反应产生影响,可是一些Cu2+ 和Fe3+的螯合物 仍会产生催化作用,催化反应速率在某种程度上是不依赖于氧的浓度,其催化 效力是金属螯合物稳定性的函数。 图 8—2 抗坏血酸的降解 粗线结构为有维生素活性的物质;H2A,还原性抗坏血酸; HA- 单阴离子抗坏血酸;A 脱氧抗坏血酸; AH·抗坏血酸自由基负离子; DKG 2,3-二酮基古罗糖酸; Mn+ 金属催催化剂; HO2·氢过氧自由基 图 8-2 也显示了 DKG 的进一步降解。由于营养价值已经损失,所以这些反 应就显得不重要了。但是这些降解产物会参与非酶褐变,最终形成风味化合物 的前体物质。不过在一些食品中,抗坏血酸的分解与非酶褐变有着密切的关系