
59.1可逆电池和可逆电极 例如: 前面所讲的Cu-Zn电池为是否为可逆电 池? 因此:实际上是不可逆的电池。 利用H在金属上有超 电势,使H2不能从阴 但可近似当作可逆电池处理 极析出。 在两溶液间插入盐 桥
§9.1 可逆电池和可逆电极 例如: 前面所讲的 Cu-Zn 电池为是否为可逆电 池? 因此:实际上是不可逆的电池。 但可近似当作可逆电池处理 利用H2在金属上有超 电势,使H2不能从阴 极析出。 在两溶液间插入盐 桥
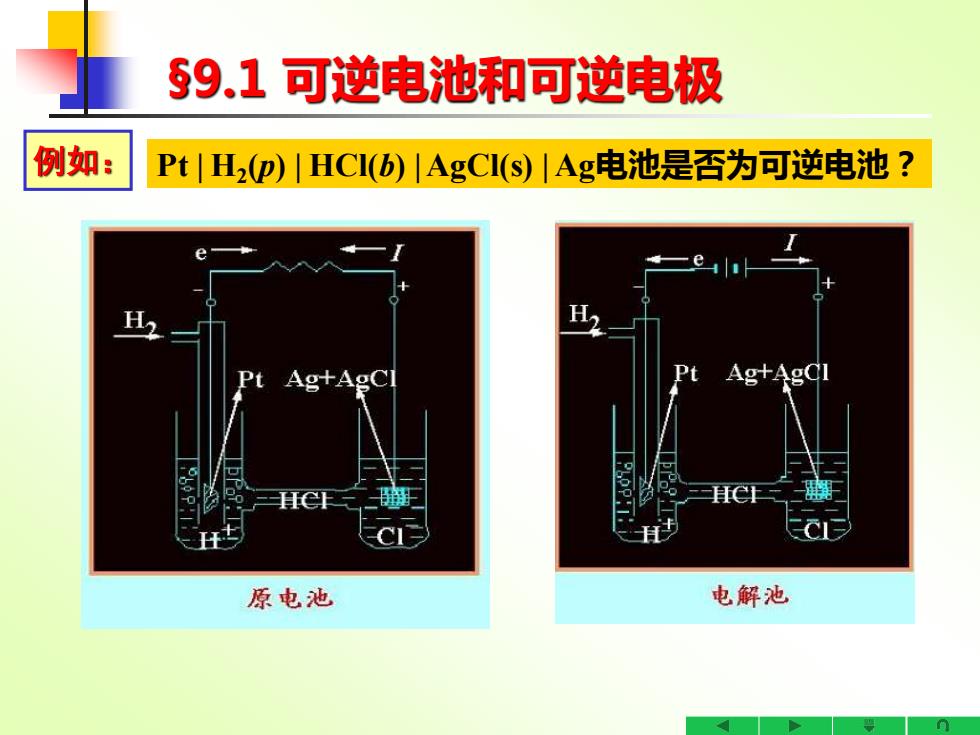
§9.1可逆电池和可逆电极 例如: Pt1H2p)1HCI(b)1AgCI(s)|Ag电池是否为可逆电池? Ag+AgC Ag+AgCl 原电池 电解池
§9.1 可逆电池和可逆电极 例如: Pt | H2 (p) | HCl(b) | AgCl(s) | Ag电池是否为可逆电池?

§9.1可逆电池和可逆电极 例如: PtH2p)川HCI(b)|AgC1(s)|Ag电池是否为可逆电池? 答:是可逆电池 因为: H2电极:放电:1/2H2(g,p)→Ht(b)+e 电解:H+(b)+e→1/2H2(g,p) Ag AgCI(s)C1-电极: 放电:AgCI(s)+e→Ag(s)+Cr(b) 电解:Ags)+C(b)→AgCl(b)+e 电极反应可逆,不存在不可逆的扩散等问题
§9.1 可逆电池和可逆电极 例如: Pt | H2 (p) | HCl(b) | AgCl(s) | Ag电池是否为可逆电池? 答:是可逆电池 因为: H2电极: 放电:1/2H2 (g,p) → H+(b)+ e- 电解:H+(b)+ e- → 1/2H2 (g,p) Ag |AgCl(s)|Cl-电极: 放电:AgCl (s)+ e-→ Ag(s) + Cl- (b) 电解:Ag(s) + Cl- (b) → AgCl(b) + e- 电极反应可逆,不存在不可逆的扩散等问题

§9.1可逆电池和可逆电极 四、可逆电极的类型和电极反应 电极按氧化态及还原态物质的状态不同分为三类: 1.第一类电极 含该元素离子的溶液丨元素单质 (1)金属电极 Mz M M++ze→M(起还原作用时) ☆有些金属在空气很活泼,或遇水发生反应,不能单独使用 则需将其钝化。 Na"(a)I Na(Hg)(a) 电极反应为:Na(a)+Hg①)+e→Na(Hg)(a)
1.第一类电极 §9.1 可逆电池和可逆电极 电极按氧化态及还原态物质的状态不同分为三类: 含该元素离子的溶液┃元素单质 (1)金属电极 Mz+ ┃ M M z+ + ze - → M(起还原作用时) 有些金属在空气很活泼,或遇水发生反应,不能单独使用 则需将其钝化。 Na+ (a΄) ┃ Na(Hg)(a) 电极反应为:Na+ (a΄) + Hg(l)+ e- → Na(Hg)(a) 四.可逆电极的类型和电极反应

四可逆电极的类型和电极反应 59.1 1.第一类电极 (1)金属电极 Mz+M M++ze→M(起还原作用时) ☆有些因实验需要,将金属作成合金来作为电极。 Sn(Sn-Bi合金)|Sn2+(a) 电极反应为:Sn+(a)+2e→Sn(Sn-Bi合金)
1.第一类电极 §9.1 (1)金属电极 Mz+ ┃ M M z+ + ze - → M(起还原作用时) 有些因实验需要,将金属作成合金来作为电极。 Sn(Sn-Bi合金)┃Sn2+(a) 电极反应为:Sn2+(a)+ 2e- → Sn(Sn-Bi合金) 四.可逆电极的类型和电极反应