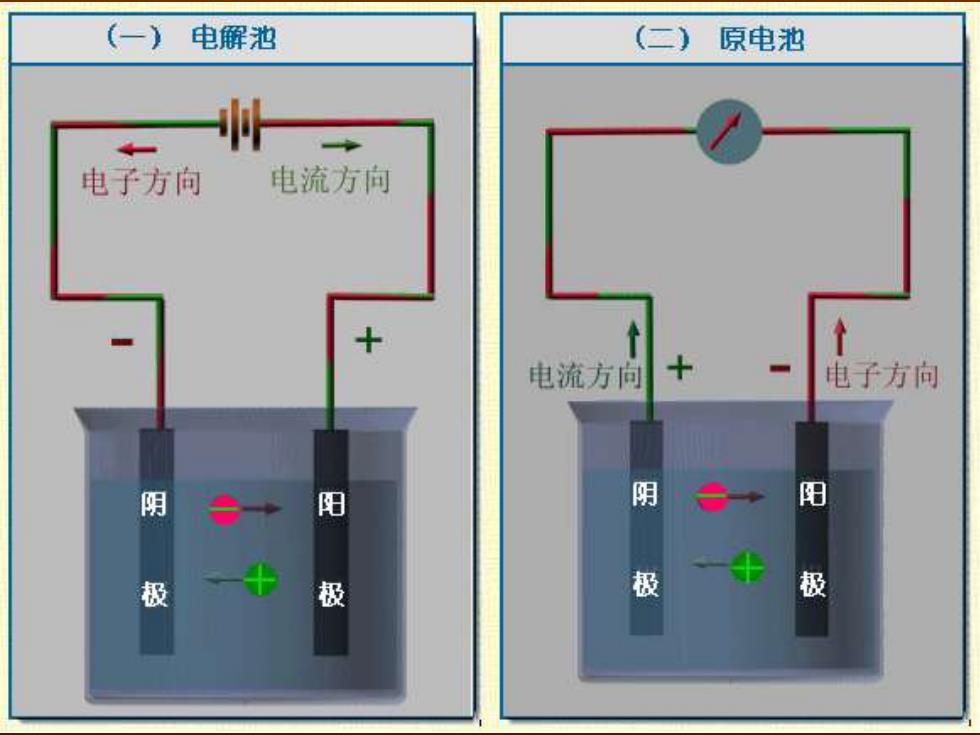
(一)电解池 (二) 原电池 电子方向 电流方向 个 电流方向 电子方向 阴 阳 阴 阳 极 极 极 极

006 2.Faraday定律(1833年) 电解时,在电极上发生反应的物质的数 量与通入的电量Q成正比。 例如:电极上发生如下反应 A++Z,e→A 则有:Q= 费ZF=n☑,R式中 Q:通入的电量(库仑) m:电极上发生反应的物质的质量 M:该物质的摩尔质量 乙:电极反应中电子的计量系数 n:电极上发生反应的量 F:1摩尔电子的电荷,称作Faraday 常数 F=N,e=6.022×105mo1×1.602×1019C =96484.6C.mol≈96500C.mo 上式表示,有1摩尔物质在电极上反应, 需要通过ZN。个电子,即通过的电量为ZF 以上公式无任何限制条件,对电池、电解 池均适用

007 $8.1溶液的电导 (一)电导定义 G- R员全=水全= ①:电阻率:单位长度,单位截面积导体的电阻; 则R= 承大 L:导线长度,与电阻成正比: A:导体的截面积,与电阻成反比。 ②量纲:21(欧姻)一西门子,用S表示, 1西门子=1安培.伏特1 ③对电解质溶液,L:两电极间的距离 A:电极的面积 ④G测定方便 一用惠斯通交流电桥直接测定, 但因为它不是特征量,使用时不方便。它与电池, 电解池的电极面积及两电极间的距离有关,也 与溶液的种类及浓度有关

008 二)电导率(比电导)K 单位面积(1m),单位长度(1m)导体的电导。 0=员=G大 K为边长1m的立方体的电解质溶液的电导, 单位是:2m1(西门子.米-1或S.m)。 ②K与几何因素L,A无关(指定边长1米),但还与电 解质性质,C,T有关(一般T个,k个)。对于强电 解质,由于浓度增加时离子数增加,故开始时C个, K个,C达到一定程度后正负离子之间的相互作用增加 使电导率下降。弱电解质K随C变化不大
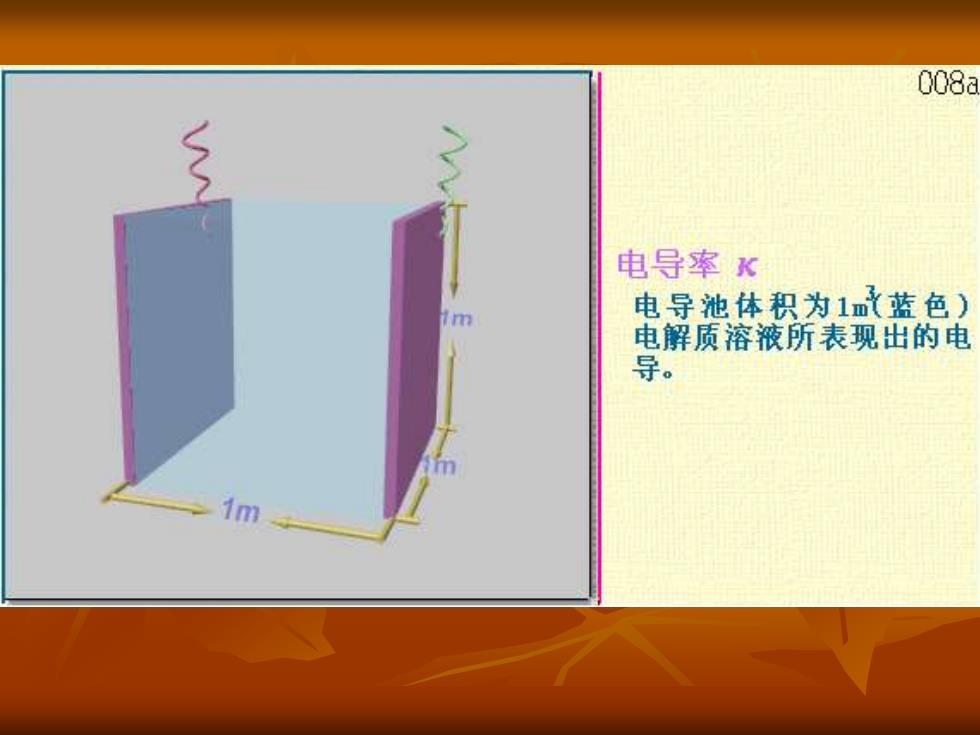
008a 电导率 电导池体积为1m蓝色) 电解质溶液所表现出的电 导