
第7章 氨基酸代谢 学习要求 (2)参与体内重要的生理活动:蛋白质是整体生 命活动的重要物质基础:体内具有多种特殊功能的蛋 熟悉蛋白质的生理功能。掌握营养必需氨基酸 白质,例如酶、某些激素抗体等 氮平衡的概念 了解蛋白质生理需要量、蛋白质营豸 (3)可以作为能源物质氧化供 :这是蛋白质的 价值和互补作用的概念,了解营养必需氨基酸的 次要功能:每克蛋白质在体内氧化分解可释放 种类。 19.17kJ能量 熟悉食物蛋白质在胃肠的消化过程,了解氨基酸 2体内蛋白质的代谢状况—氨平衡街 在小肠的吸收方式。掌握蛋白质腐败作用的概念,了 balance).摄人含物的含氢 解假神经递质的制会了解蛋白质的产物及对 量与排泄物(尿与粪)中含氯量之间的关系 人类健康的利弊 氮总平衡:摄入氮=排出氨(正常成人 了解体内蛋白质的分解方式,氨基酸代谢库的 氮正平衡:摄入氮>挂出氮(儿童、孕妇等)】 念。掌握氨基酸的转氨基作用、丙氨酸氨基转氨酶阻 氢负平衡,摄入氢排出氢(机饿,消耗性疾病患者 化的反应与辅酶,熟悉氧化脱氨基、联合脱氨基作用 2)氨平衡的意义:可以反映体内蛋白质代谢的 了解嘌呤核苷酸循环。熟悉仪酮酸的代谢途径,了解 生糖氨基酸生留氨基酸与生锁章生丽氨基酸的极 (3)蛋白质的生理需要量:成人每日蛋白质最低 掌握体内氨的来源,去路 酸葡萄糖 生理需要量为30-50g,我国营养学会推荐成人每日 蛋白质需要量为80g。 要过程、关键酶及其生理意义。了解尿素合成的黄 3.蛋白质的营养价值 节。了解高氨血症和氨中毒。 1)营养必需氨基酸(essential amino acid),是指 熟悉氨基酸的脱羧基作用。了解,氨基丁酸 体内需要而又不能自身合成,必须由食物供给的氨基 (GABA),组胺,5羟色胺,多胺类物质的生成及作用。 酸,共有8种:缬、 亮苯内 色」 掌握一碳单位的概念、种类 载体 生成原料及主要生 其余12种氨基酸体内可以合成,称为营养非必 理作用,了解其生成过程及相互转变。掌握S腺苷耳 需氨基酸。 硫氨酸(SAM)的生成、作用及其与一碳单位代明的联 ●精氨酸和组氨酸人体虽能合成但合成量不多,故有 系,了解甲硫氨酸循环及其生理意义维生素B,在循 时也被日为营养必需氢基酸 环中的作用。了解肌酸与磷酸肌酸的合成与分解.了 ●营养必需氨基酸的同音记忆:写一两本淡色书来(缬。 解活性硫酸根牛磺酸的生成。掌据用基与硫酸根在 体内的活化形式。熟悉苯丙氨酸转变成酪氨酸的过 程,苯丙氨酸羟化酶及其辅醇,熟悉酪氨酸在体内的 在体内的利用 ,取决于必需氨基酸的 转变产物。了解儿茶酚胺的合成、关键、帕金森氏 量种类量质比。 病与儿茶酚胺的关系。了解黑色素的合成关键酶 (3)蛋白质的互补作用:指营养价值较低的蛋白 与白化病的关系。了解酪氨酸的彻底氧化与尿黑酸 质混合食用其必需氨基酸可以互相补充而提高营养 尿症的关系了解支链氨基酸的分解代则过程。 价值」 讲义要点 (二)蛋白质的消化、吸收和腐败 1.外源性蛋白质消化成氢基酸和寡肽后被吸收 (一)蛋白质的营养作用 蛋白质在胃和肠道蛋白质被消化成氨基酸和素肽 1蛋白质的重要功能 由大分子转变为小分子,便于吸收。消除种属特异性 ()维持组织细胞的生长,更新与修补:蛋白质 和抗原性,防止过敏,毒性反应 是细胞组织的主要成分,因此,参与构成各种细胞组 蛋白质在胃中被水解成多肽和氨基酸(产物主要 织是蛋白质最重要的功能。 为多肽及少量氨基酸)。在小肠中,多肽被胰腺所分泌 ·78
78 第 7 章 氨基酸代谢 学 习 要 求 熟悉蛋白质的生理功能ꎮ 掌握营养必需氨基酸、 氮平衡的概念ꎬ了解蛋白质生理需要量、蛋白质营养 价值和互补作用的概念ꎬ了解营养必需氨基酸的 种类ꎮ 熟悉食物蛋白质在胃肠的消化过程ꎬ了解氨基酸 在小肠的吸收方式ꎮ 掌握蛋白质腐败作用的概念ꎬ了 解假神经递质的概念ꎬ了解蛋白质的腐败产物及其对 人类健康的利弊ꎮ 了解体内蛋白质的分解方式、氨基酸代谢库的概 念ꎮ 掌握氨基酸的转氨基作用、丙氨酸氨基转氨酶催 化的反应与辅酶ꎬ熟悉氧化脱氨基、联合脱氨基作用ꎮ 了解嘌呤核苷酸循环ꎮ 熟悉 α ̄酮酸的代谢途径ꎬ了解 生糖氨基酸、生酮氨基酸与生糖兼生酮氨基酸的概 念ꎮ 掌握体内氨的来源、去路ꎬ熟悉丙氨酸 ̄葡萄糖循 环及谷氨酰胺的运氨作用ꎬ掌握尿素合成的部位、主 要过程、关键酶及其生理意义ꎮ 了解尿素合成的调 节ꎮ 了解高氨血症和氨中毒ꎮ 熟悉氨基酸的脱羧基作用ꎮ 了解 γ ̄氨基丁酸 (GABA)、组胺、5 ̄羟色胺、多胺类物质的生成及作用ꎮ 掌握一碳单位的概念、种类、载体、生成原料及主要生 理作用ꎬ了解其生成过程及相互转变ꎮ 掌握 S ̄腺苷甲 硫氨酸(SAM)的生成、作用及其与一碳单位代谢的联 系ꎬ了解甲硫氨酸循环及其生理意义、维生素 B12在循 环中的作用ꎮ 了解肌酸与磷酸肌酸的合成与分解ꎬ了 解活性硫酸根、牛磺酸的生成ꎮ 掌握甲基与硫酸根在 体内的活化形式ꎮ 熟悉苯丙氨酸转变成酪氨酸的过 程、苯丙氨酸羟化酶及其辅酶ꎬ熟悉酪氨酸在体内的 转变产物ꎮ 了解儿茶酚胺的合成、关键酶、帕金森氏 病与儿茶酚胺的关系ꎮ 了解黑色素的合成、关键酶、 与白化病的关系ꎮ 了解酪氨酸的彻底氧化与尿黑酸 尿症的关系ꎮ 了解支链氨基酸的分解代谢过程ꎮ 讲 义 要 点 (一) 蛋白质的营养作用 1 蛋白质的重要功能 (1) 维持组织细胞的生长、更新与修补:蛋白质 是细胞组织的主要成分ꎬ因此ꎬ参与构成各种细胞组 织是蛋白质最重要的功能ꎮ (2) 参与体内重要的生理活动:蛋白质是整体生 命活动的重要物质基础ꎻ体内具有多种特殊功能的蛋 白质ꎬ例如酶、某些激素、抗体等ꎮ (3) 可以作为能源物质氧化供能:这是蛋白质的 次要 功 能ꎻ 每 克 蛋 白 质 在 体 内 氧 化 分 解 可 释 放 19 17 kJ能量ꎮ 2 体内蛋白质的代谢状况———氮平衡 (1) 氮平衡( nitrogen balance):摄入食物的含氮 量与排泄物(尿与粪)中含氮量之间的关系ꎮ 氮总平衡:摄入氮 = 排出氮(正常成人) 氮正平衡:摄入氮>排出氮(儿童、孕妇等) 氮负平衡:摄入氮<排出氮(饥饿、消耗性疾病患者) { (2) 氮平衡的意义:可以反映体内蛋白质代谢的 概况ꎮ (3) 蛋白质的生理需要量:成人每日蛋白质最低 生理需要量为 30 ~ 50gꎬ我国营养学会推荐成人每日 蛋白质需要量为 80gꎮ 3 蛋白质的营养价值 (1) 营养必需氨基酸(essential amino acid):是指 体内需要而又不能自身合成ꎬ必须由食物供给的氨基 酸ꎬ共有 8 种:缬、异亮、亮、苯丙、蛋、色、苏、赖氨酸ꎮ 其余 12 种氨基酸体内可以合成ꎬ称为营养非必 需氨基酸ꎮ ●精氨酸和组氨酸人体虽能合成ꎬ但合成量不多ꎬ故有 时也被归为营养必需氨基酸ꎮ ●营养必需氨基酸的同音记忆:写一两本淡色书来(缬 ̄ 异 ̄亮 ̄苯 ̄蛋 ̄色 ̄苏 ̄赖)ꎮ (2) 蛋白质的营养价值:蛋白质的营养价值是指 食物蛋白质在体内的利用率ꎬ取决于必需氨基酸的数 量、种类、量质比ꎮ (3) 蛋白质的互补作用:指营养价值较低的蛋白 质混合食用ꎬ其必需氨基酸可以互相补充而提高营养 价值ꎮ (二) 蛋白质的消化、吸收和腐败 1 外源性蛋白质消化成氨基酸和寡肽后被吸收 蛋白质在胃和肠道蛋白质被消化成氨基酸和寡肽ꎬ 由大分子转变为小分子ꎬ便于吸收ꎮ 消除种属特异性 和抗原性ꎬ防止过敏、毒性反应ꎮ 蛋白质在胃中被水解成多肽和氨基酸(产物主要 为多肽及少量氨基酸)ꎮ 在小肠中ꎬ多肽被胰腺所分泌
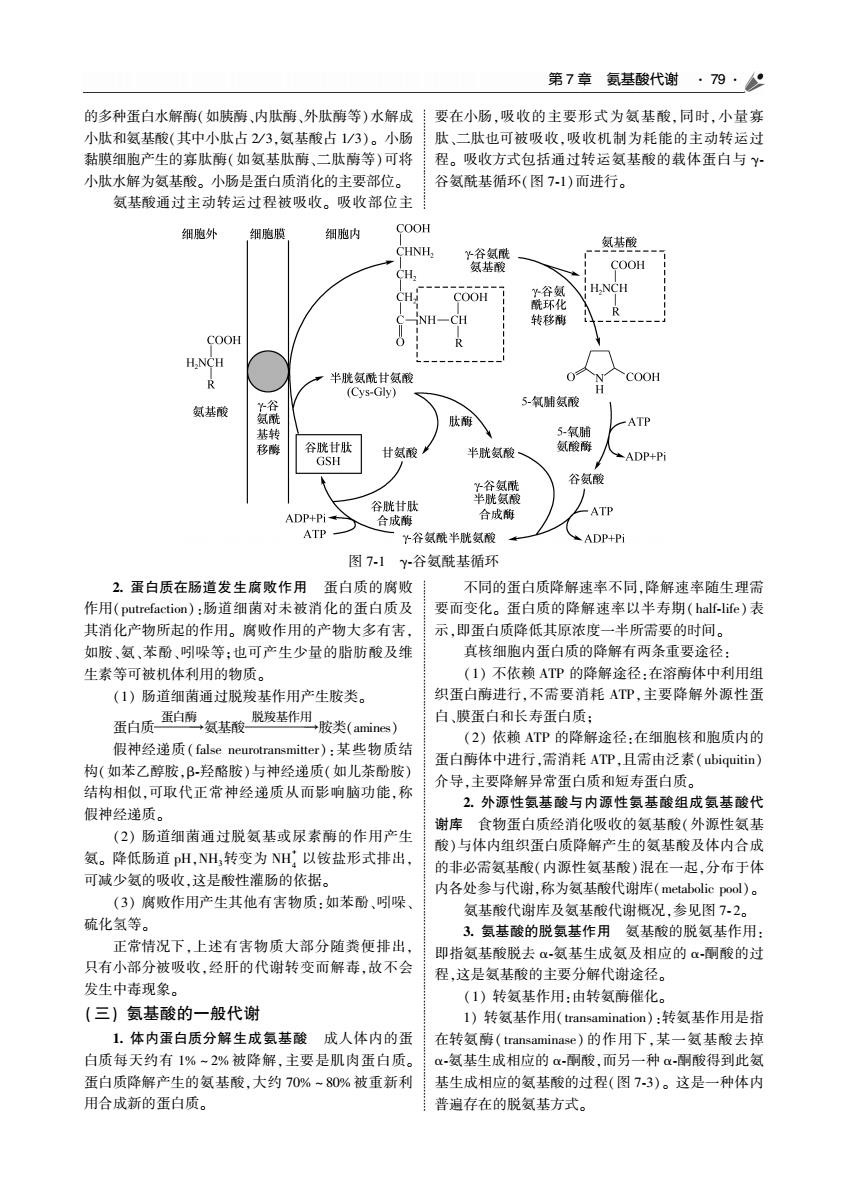
第7章氨基酸代谢·79·以 的多种蛋白水解爵(如胰酶,内肽酶、外肽酶等)水解成!要在小肠,吸收的主要形式为氨基酸,同时,小量寡 小肽和氨基酸(其中小肽占23,氨基酸占1/3)。小肠肽、二肽也可被吸收,吸收机制为耗能的主动转运过 黏膜细胞产生的寡肽酶(如氨基肽酶、二肽酶等)可将 程。吸收方式包括通过转运氨基酸的载体蛋白与Y 小肚水解为氨甚酸、小肠是蛋白质消化的主要部位 谷氨酰其循环(图7.1)而进行」 氨基酸通过主动转运过程被吸收。吸收部位主 细胞外 细胞内 C00 CH COOH NH-CH COOH COOH 氨酸 5氧雕氨酸 秋酶 移酸 半胱氨 ADP+P 谷氨酸 ATP 外谷氨酸半胱氨酸 ADP+P 图71y-谷氨酰基循环 2.蛋白质在肠道发生腐败作用 蛋白质的腐 不同的蛋白质降解速率不同,降解速率随生理周 作用(putrefaction):肠道细菌对未被消化的蛋白质及 要而变化。蛋白质的降解速率以半寿期(half-life)表 其消化产物所起的作用。腐败作用的产物大多有害, 示,即蛋白质降低其原浓度一半所需要的时问。 如胺氨装酚引吸等,也可产生少最的脂肪酸及维 直核细胞内蛋白质的隆解右两条重要涂径 生素等可被机体利用的物质 (1)不依赖ATP的降解途径:在溶体中利用组 (1)肠道细菌通过脱羧基作用产生胺类。 织蛋白酶进 ,不 要消耗ATP,主要降解外源性 蛋白质蛋白葡氨基酸基作用胶类(amie) 白、膜蛋白和长寿蛋白质: (2)依ATP的降解途径:在细胞核和胞质内的 假神经递质(alse neurotransmitter),某些物质结 蛋白酶体中进行,需消耗ATP,且需由泛素(biquitin) 构(如苯乙醇胺,B.羟酪按)与神经递质(如儿茶酚胺) 个导,主要降解异常蛋白质和短寿蛋白质 结构相似可取代正常神经递质从而影响脑功能称 2.外源性氢其酸与内源性氧其酸组成氢基酸代 假神经递质 (2)肠道细菌通过脱氨基或尿索醇的作用产生 食物蛋白质经消化吸 )与体内 的实 基酸(外酒 织蛋白 基酸及 氨。降低肠道pH,NH,转变为NH,以铵盐形式排出, 可减少氨的吸收汶是酸性灌肠的依据」 的非必需氨基酸(内源性氨基酸)混在一起,分布于体 内各处参与代谢,称为氨基酸代谢库(metabolic pool)。 (3)腐败作用产生其他有害物质,如苯酚.哚 氨基酸代谢库及氨基酸代谢概况,参见图72。 硫化氢等。 3.氨基酸的脱氨基作用氨基酸的脱氨基作用 正常情况下 ,上述有害物质 大部分随粪便排出 围指氨甚酸去甚生成氨及相应的酸的过 只有小部分被吸收经肝的代谢转变而解毒,故不会 程,这是氨基酸的主要分解代谢途径。 发生中毒现象。 (1)转氨基作用:由转氨酶催化 (三)氨基酸的一般代谢 1)转氨基作用(transamination):转氨基作用是指 1.体内蛋白质分解生成氨基酸成人体内的蛋 在转氨酶(ran minase)的作用下,某一氨基酸去掉 白质每天约有1%一2%被降解,主要是肌肉蛋白质。 .怎基牛成相应的a:图酸而另种α围酸得到此氨 蛋白质降解产生的氨基酸,大约70%一80%被重新利 基生成相应的氢基酸的过程(图7.3)。这是一种体内 用合成新的蛋白质 普遍存在的脱氨基方式
第 7 章 氨基酸代谢 79 的多种蛋白水解酶(如胰酶、内肽酶、外肽酶等)水解成 小肽和氨基酸(其中小肽占 2/ 3ꎬ氨基酸占 1/ 3)ꎮ 小肠 黏膜细胞产生的寡肽酶(如氨基肽酶、二肽酶等)可将 小肽水解为氨基酸ꎮ 小肠是蛋白质消化的主要部位ꎮ 氨基酸通过主动转运过程被吸收ꎮ 吸收部位主 要在小肠ꎬ吸收的主要形式为氨基酸ꎬ同时ꎬ小量寡 肽、二肽也可被吸收ꎬ吸收机制为耗能的主动转运过 程ꎮ 吸收方式包括通过转运氨基酸的载体蛋白与 γ ̄ 谷氨酰基循环(图 7 ̄1)而进行ꎮ 图 7 ̄1 γ ̄谷氨酰基循环 2 蛋白质在肠道发生腐败作用 蛋白质的腐败 作用(putrefaction):肠道细菌对未被消化的蛋白质及 其消化产物所起的作用ꎮ 腐败作用的产物大多有害ꎬ 如胺、氨、苯酚、吲哚等ꎻ也可产生少量的脂肪酸及维 生素等可被机体利用的物质ꎮ (1) 肠道细菌通过脱羧基作用产生胺类ꎮ 蛋白质 蛋白酶 →氨基酸 脱羧基作用 →胺类(amines) 假神经递质( false neurotransmitter):某些物质结 构(如苯乙醇胺ꎬβ ̄羟酪胺)与神经递质(如儿茶酚胺) 结构相似ꎬ可取代正常神经递质从而影响脑功能ꎬ称 假神经递质ꎮ (2) 肠道细菌通过脱氨基或尿素酶的作用产生 氨ꎮ 降低肠道 pHꎬNH3转变为 NH + 4 以铵盐形式排出ꎬ 可减少氨的吸收ꎬ这是酸性灌肠的依据ꎮ (3) 腐败作用产生其他有害物质:如苯酚、吲哚、 硫化氢等ꎮ 正常情况下ꎬ上述有害物质大部分随粪便排出ꎬ 只有小部分被吸收ꎬ经肝的代谢转变而解毒ꎬ故不会 发生中毒现象ꎮ (三) 氨基酸的一般代谢 1 体内蛋白质分解生成氨基酸 成人体内的蛋 白质每天约有 1% ~ 2% 被降解ꎬ主要是肌肉蛋白质ꎮ 蛋白质降解产生的氨基酸ꎬ大约 70% ~ 80% 被重新利 用合成新的蛋白质ꎮ 不同的蛋白质降解速率不同ꎬ降解速率随生理需 要而变化ꎮ 蛋白质的降解速率以半寿期( half ̄life)表 示ꎬ即蛋白质降低其原浓度一半所需要的时间ꎮ 真核细胞内蛋白质的降解有两条重要途径: (1) 不依赖 ATP 的降解途径:在溶酶体中利用组 织蛋白酶进行ꎬ不需要消耗 ATPꎬ主要降解外源性蛋 白、膜蛋白和长寿蛋白质ꎻ (2) 依赖 ATP 的降解途径:在细胞核和胞质内的 蛋白酶体中进行ꎬ需消耗 ATPꎬ且需由泛素( ubiquitin) 介导ꎬ主要降解异常蛋白质和短寿蛋白质ꎮ 2 外源性氨基酸与内源性氨基酸组成氨基酸代 谢库 食物蛋白质经消化吸收的氨基酸(外源性氨基 酸)与体内组织蛋白质降解产生的氨基酸及体内合成 的非必需氨基酸(内源性氨基酸)混在一起ꎬ分布于体 内各处参与代谢ꎬ称为氨基酸代谢库(metabolic pool)ꎮ 氨基酸代谢库及氨基酸代谢概况ꎬ参见图 7 ̄ 2ꎮ 3 氨基酸的脱氨基作用 氨基酸的脱氨基作用: 即指氨基酸脱去 α ̄氨基生成氨及相应的 α ̄酮酸的过 程ꎬ这是氨基酸的主要分解代谢途径ꎮ (1) 转氨基作用:由转氨酶催化ꎮ 1) 转氨基作用(transamination):转氨基作用是指 在转氨酶( transaminase) 的作用下ꎬ某一氨基酸去掉 α ̄氨基生成相应的 α ̄酮酸ꎬ而另一种 α ̄酮酸得到此氨 基生成相应的氨基酸的过程(图 7 ̄3)ꎮ 这是一种体内 普遍存在的脱氨基方式ꎮ
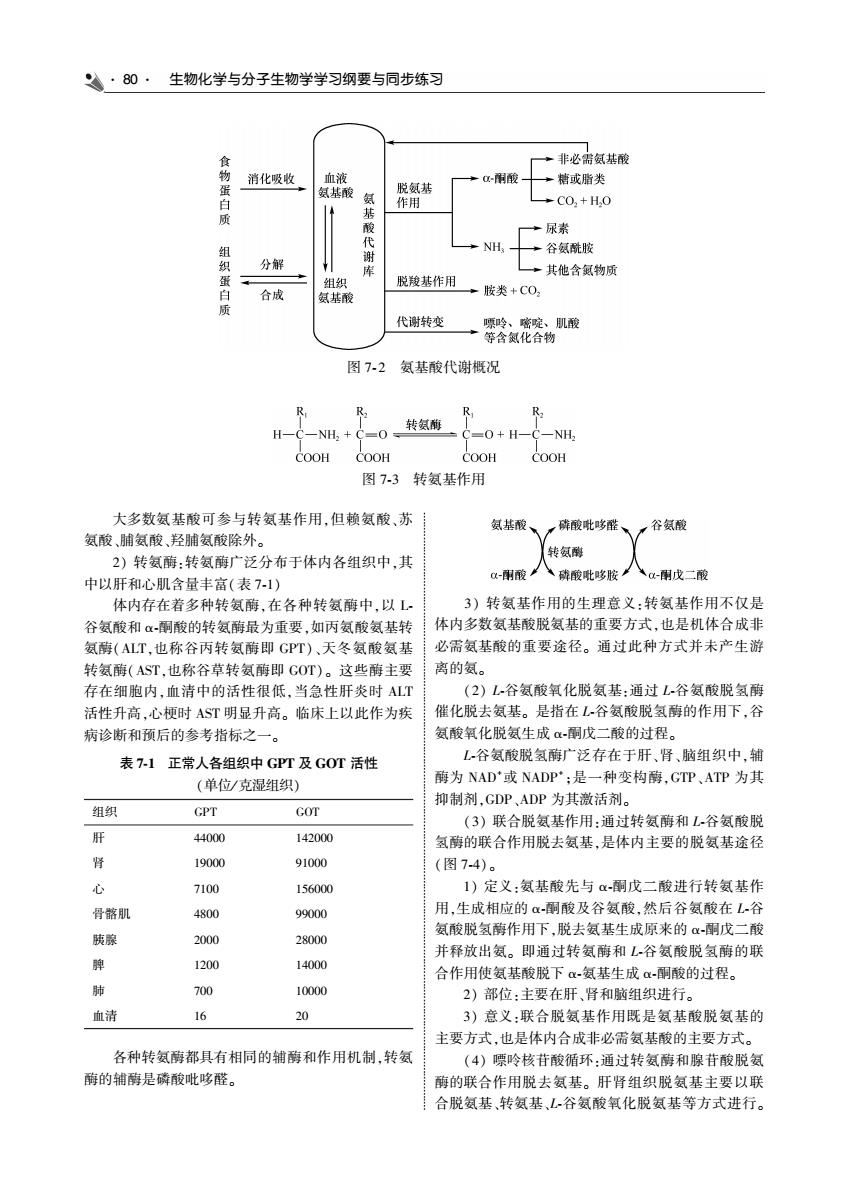
·80·生物化学与分子生物学学习纲要与同步练习 一→非必需氨基酸 消化吸收 一糖或脂类 ◆CO,+HO 口所 尿素 NH 分解 其他含氨物质 脱羧基作用 合战 一胺类+C0, 代谢转变 图7-2 氨基酸代谢概况 R 转氨酶 H-C-NH, =0 -0+H-C-NH, COOH COOH 图73转氨基作用 大多数氨基酸可参与转氨基作用,但赖氨酸、苏 氨基酸、 ,酸吡哆醛、 一谷氨酸 氨酸、脯氨酸、羟脯氨酸除外。 转氨倒 2)转氨酶:转氨酶广泛分布于体内各组织中,其 中以肝和心肌含量丰富(表71) 以酮酸八硝酸毗哆胺八以:雨成二酸 体内存在着多种转氨酶.在各种转氨酶中,以L 3)转氨基作用的生理意义:转氨基作用不仅是 体内多数氨基酸脱氨基的重要方式,也是机体合成非 氨酶(ALT,也称谷丙转氨酶即 必需氨基酸的重要涂径。面此种方式并未产生 转氨酶(AST,也称谷草转氨酶即GOT) 。这些箭主要 离的氨 存在细胞内,血清中的活性很低,当急性肝炎时ALT (2)谷氨酸氧化脱氨基:通过L谷氨酸脱氢酮 活性升高,心梗时AST明显升高。临床上以此作为疾 催化脱去氨基。是指在L,谷氨酸脱氢爵的作用下,谷 病诊断和预后的参考指标之一。 氨酸氧化脱氨生成α酮戊二酸的过程。 表7-1正常人各组织中GPT及G0T活性 谷氨酸脱氢酶广泛存在于肝、肾、脑组织中,辅 (单位/克混组织) 酶为NAD'或NADP';是一种变构酶,GTP、ATP为其 抑制剂,GDP,ADP为其激活剂。 组织 GPT COT (3)联合脱氨基作用:通过转氨酶和L谷氨酸脱 44000 142000 氢醇的联合作用脱去氨基,是体内主要的脱氨基途径 19000 91000 图74) 710 156000 1)定义,氨其酸先与但丽戊一酸进行转氨基作 骨肌 4800 99000 用,生成相应的α酮酸及谷氨酸,然后谷氨酸在L谷 胰腺 2000 28000 氨酸脱氢 作用下,脱去氨 成原来的 并释放出氨。即通过转氨酶和L谷氨酸脱氢酶的联 1200 14000 合作用使氨基酸脱下-氨基生成α-酮酸的过程。 700 2)部位:主要在肝、肾和脑组织进行。 血清 16 20 3)意义:联合脱氨基作用既是氨基酸脱氨基的 主要方式,也是体内合成非必需氨基酸的主要方式。 各种转氨酶都具有相同的轴酶和作用机制,转氨 (4)嘌吟核苷酸循环:通过转氨酶和腺苷酸脱氨 酶的辅酶是磷酸吡哆醛 事的联合作用脱去氨基。肝肾组织脱氨基主要以吧 合脱氨基转氨基,L谷氨酸氧化脱氨基等方式进行
80 生物化学与分子生物学学习纲要与同步练习 图 7 ̄ 2 氨基酸代谢概况 图 7 ̄3 转氨基作用 大多数氨基酸可参与转氨基作用ꎬ但赖氨酸、苏 氨酸、脯氨酸、羟脯氨酸除外ꎮ 2) 转氨酶:转氨酶广泛分布于体内各组织中ꎬ其 中以肝和心肌含量丰富(表 7 ̄1) 体内存在着多种转氨酶ꎬ在各种转氨酶中ꎬ以 L ̄ 谷氨酸和 α ̄酮酸的转氨酶最为重要ꎬ如丙氨酸氨基转 氨酶(ALTꎬ也称谷丙转氨酶即 GPT)、天冬氨酸氨基 转氨酶(ASTꎬ也称谷草转氨酶即 GOT)ꎮ 这些酶主要 存在细胞内ꎬ血清中的活性很低ꎬ当急性肝炎时 ALT 活性升高ꎬ心梗时 AST 明显升高ꎮ 临床上以此作为疾 病诊断和预后的参考指标之一ꎮ 表 7 ̄1 正常人各组织中 GPT 及 GOT 活性 (单位/ 克湿组织) 组织 GPT GOT 肝 44000 142000 肾 19000 91000 心 7100 156000 骨髂肌 4800 99000 胰腺 2000 28000 脾 1200 14000 肺 700 10000 血清 16 20 各种转氨酶都具有相同的辅酶和作用机制ꎬ转氨 酶的辅酶是磷酸吡哆醛ꎮ 3) 转氨基作用的生理意义:转氨基作用不仅是 体内多数氨基酸脱氨基的重要方式ꎬ也是机体合成非 必需氨基酸的重要途径ꎮ 通过此种方式并未产生游 离的氨ꎮ (2) L ̄谷氨酸氧化脱氨基:通过 L ̄谷氨酸脱氢酶 催化脱去氨基ꎮ 是指在 L ̄谷氨酸脱氢酶的作用下ꎬ谷 氨酸氧化脱氨生成 α ̄酮戊二酸的过程ꎮ L ̄谷氨酸脱氢酶广泛存在于肝、肾、脑组织中ꎬ辅 酶为 NAD +或 NADP + ꎻ是一种变构酶ꎬGTP、ATP 为其 抑制剂ꎬGDP、ADP 为其激活剂ꎮ (3) 联合脱氨基作用:通过转氨酶和 L ̄谷氨酸脱 氢酶的联合作用脱去氨基ꎬ是体内主要的脱氨基途径 (图 7 ̄4)ꎮ 1) 定义:氨基酸先与 α ̄酮戊二酸进行转氨基作 用ꎬ生成相应的 α ̄酮酸及谷氨酸ꎬ然后谷氨酸在 L ̄谷 氨酸脱氢酶作用下ꎬ脱去氨基生成原来的 α ̄酮戊二酸 并释放出氨ꎮ 即通过转氨酶和 L ̄谷氨酸脱氢酶的联 合作用使氨基酸脱下 α ̄氨基生成 α ̄酮酸的过程ꎮ 2) 部位:主要在肝、肾和脑组织进行ꎮ 3) 意义:联合脱氨基作用既是氨基酸脱氨基的 主要方式ꎬ也是体内合成非必需氨基酸的主要方式ꎮ (4) 嘌呤核苷酸循环:通过转氨酶和腺苷酸脱氨 酶的联合作用脱去氨基ꎮ 肝肾组织脱氨基主要以联 合脱氨基、转氨基、L ̄谷氨酸氧化脱氨基等方式进行ꎮ
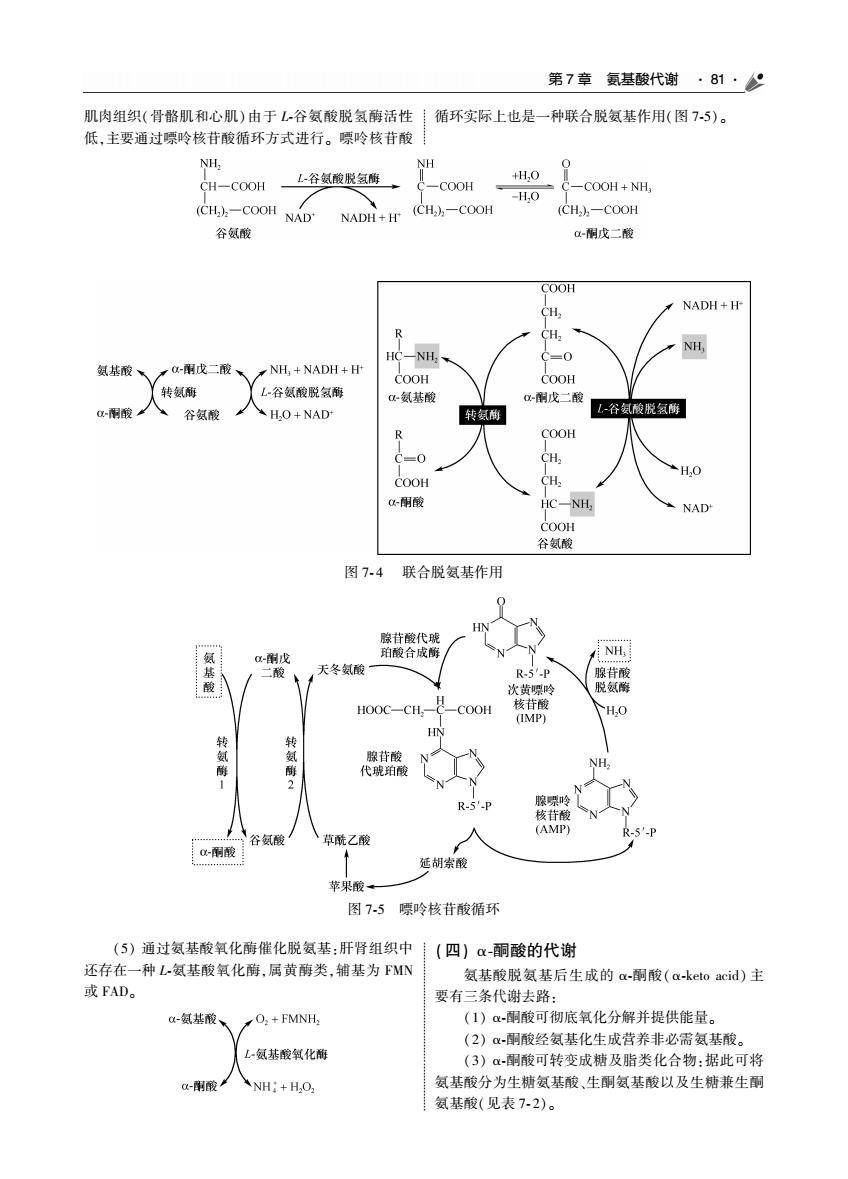
第7章氨基酸代谢·81·公 肌肉组织(骨酪肌和心肌)由于L,谷氨酸脱氢醇活性循环实际上也是一种联合脱氨基作用(图75)。 低,主要通过紧呤核苷酸循环方式进行。嘌呤核苷酸 NH CH-COOH 上谷氨酸脱氢廊、 -COOH ,0 C-COOH+NH -1H.0 CH,。-COOH NAD NADH+H (CH.)-COOH (CH)-COOH 谷氨酸 酮成二酸 COOH NADH+ -NH. C=0 氨基酸、 雨戊二酸、 NH,+NADH+H 谷氨酸联氢刷 COOH COOH 转氨群 酸 -氨基酸 -戊二酸 谷氨酸 H.O+NAD 转氨利 公 NAD 图74联合脱氨基作用 NH. 天冬氨酸 HOOC-CH-2-COOH HO 转 转氨酶。 代 N R-5 容氨酸 雨酸 草酸乙酸 苹果酸 图7-5嘌吟核苷酸循环 (5)通过氨基酸氧化酶催化脱氨基:肝肾组织中(四)α酮酸的代谢 还存在一种L氨基酸氧化酶,属黄酶类,锢基为FMN 氨基酸脱氨基后生成的a酮酸(a-keto acid)主 或FAD 要有三条代谢去路 0-氨基酸 O:+FMNH. (1)α-酮酸可彻底氧化分解并提供能量。 (2)a-酮酸经氨基化生成营养非必需氨基酸。 氨基酸氧化 (3)α-酮酸可转变成糖及脂类化合物:据此可将 NH:+HO. 氨基酸分为生糖氨基酸,生酮氨基酸以及生糖兼生酮 氨基酸(见表7-2)
第 7 章 氨基酸代谢 81 肌肉组织(骨骼肌和心肌)由于 L ̄谷氨酸脱氢酶活性 低ꎬ主要通过嘌呤核苷酸循环方式进行ꎮ 嘌呤核苷酸 循环实际上也是一种联合脱氨基作用(图 7 ̄5)ꎮ 图 7 ̄ 4 联合脱氨基作用 图 7 ̄5 嘌呤核苷酸循环 (5) 通过氨基酸氧化酶催化脱氨基:肝肾组织中 还存在一种 L ̄氨基酸氧化酶ꎬ属黄酶类ꎬ辅基为 FMN 或 FADꎮ (四) α ̄酮酸的代谢 氨基酸脱氨基后生成的 α ̄酮酸(α ̄keto acid) 主 要有三条代谢去路: (1) α ̄酮酸可彻底氧化分解并提供能量ꎮ (2) α ̄酮酸经氨基化生成营养非必需氨基酸ꎮ (3) α ̄酮酸可转变成糖及脂类化合物:据此可将 氨基酸分为生糖氨基酸、生酮氨基酸以及生糖兼生酮 氨基酸(见表 7 ̄ 2)ꎮ
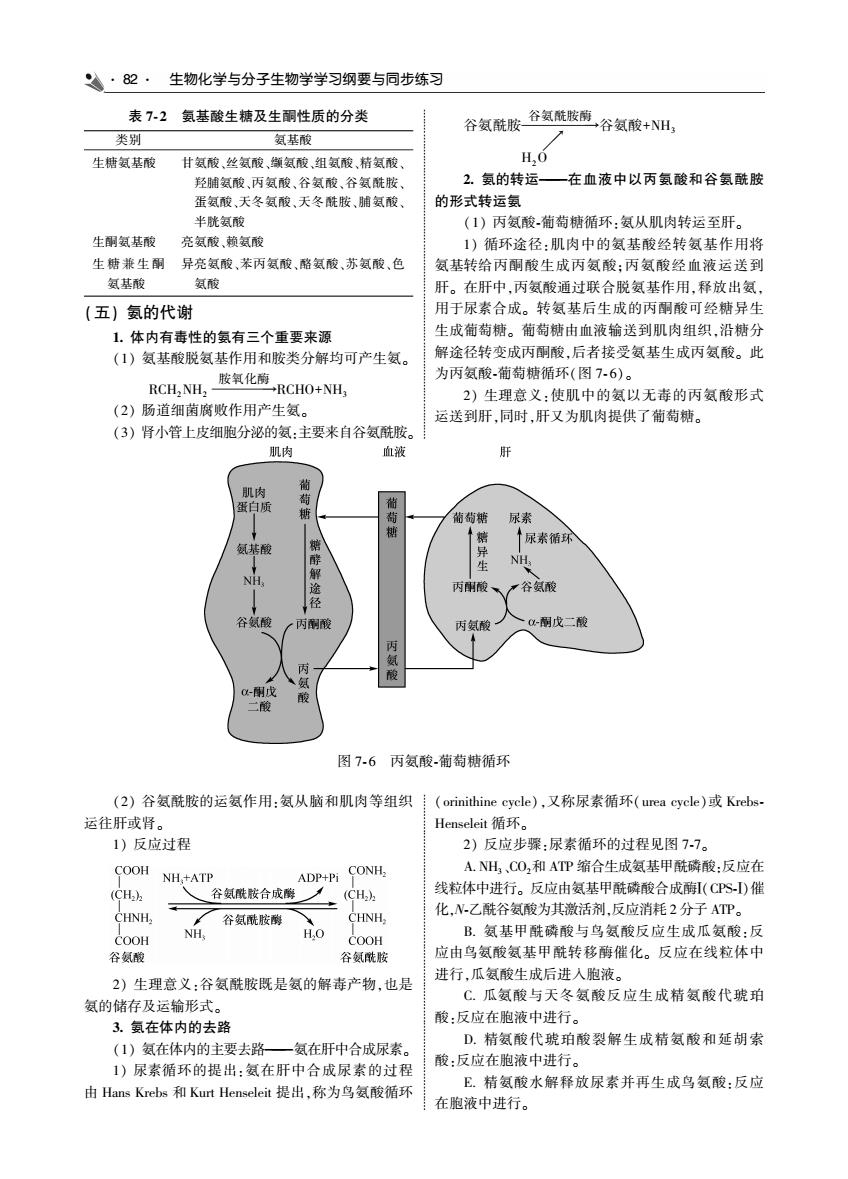
·2·生物化学与分子生物学学习纲要与同步练习 表72氨基酸生糖及生酮性质的分类 谷氨酰胶谷氢陆胺谷氨酸+, 类别 氨基酸 生糖氨基酸甘氨酸丝氨酸、缬氨酸,组氨酸,精氨酸、 0 羟随氨酸,丙氨酸、谷氨酸、谷氨酰胺 2.氨的转运 一在血液中以丙氨酸和谷氨酰胺 蛋氨酸,天冬氨酸、天冬酰胺、随氨酸 的形式转运氢 半酰氨酸 《1)丙氨酸椭萄锁循环,氨从肌肉转运至肝 生即氨基酸 亮氨酸,赖氨酸 1)循环途径,肌肉中的氨基酸经转氨基作用将 生糖兼生附异亮氨酸,苯丙氨酸、酪氨酸、苏氨酸、色 氨基转给丙酮酸生成丙氨酸:丙氨酸经血液运送到 氨基酸 氨酸 (五)氨的代谢 可经糖异 生成葡萄糖。葡萄糖由血液输送到肌肉组织,沿糖分 交后足 解途径转变成丙酮酸,后者接受氨基生成丙氨酸。此 为丙氨酸葡萄糖循环(图7-6)。 2)生理意义:使肌中的氨以无毒的丙氨酸形式 (2)肠道细菌腐败作用产生氨。 运送到肝,同时,肝又为肌肉提供了葡萄糖。 (3)肾小管上皮细胞分泌的氨:主要来自谷氨酰胺。 肌肉 血被 肝 肌肉 谷氨酸 酮戊二酸 图76丙氨酸葡萄糖循环 (2)谷氨酰胺的运氨作用:氨从脑和肌肉等组织i(orinithine evcle),又称尿素循环(urea cycle)或Krebs 运往肝或肾。 Henseleit循环。 1)反应过程 2)反应北骤.尿素循环的过得贝图77 COOH NHATP ADP+Pi CONH, A.NH,C0,和ATP缩合生成氨基甲酰磷酸:反应在 (CH.) 严谷氨辰核合成形乙以 线粒体中进行。 成醇(CS-D催 化水乙 “A H,o B.氨基甲酰磷酸与鸟氨酸反应生成瓜氨酸:因 谷 应由鸟氨酸氨基甲酰转移酶催化。反应在线粒体中 2)生理意义:谷氨酰胺既是氨的解毒产物,也是 进行,瓜氨酸生成后进入胞液。 氨的储存及运输形式。 C.瓜氨酸与天冬氨酸反应生成精氨酸代琥珀 酸:反应在胞液中进行。 氨在体内 的主要去影 氨在肝中合成尿索 1)尿素循环的提出:氨在肝中合成尿素的过程 由Hans Krebs和Kurt Henseleit提出,称为鸟氨酸循环 E.精氨酸水解释放尿素并再生成鸟氨酸:反应 在胞液中进行
82 生物化学与分子生物学学习纲要与同步练习 表 7 ̄ 2 氨基酸生糖及生酮性质的分类 类别 氨基酸 生糖氨基酸 甘氨酸、丝氨酸、缬氨酸、组氨酸、精氨酸、 羟脯氨酸、丙氨酸、谷氨酸、谷氨酰胺、 蛋氨酸、天冬氨酸、天冬酰胺、脯氨酸、 半胱氨酸 生酮氨基酸 亮氨酸、赖氨酸 生 糖 兼 生 酮 氨基酸 异亮氨酸、苯丙氨酸、酪氨酸、苏氨酸、色 氨酸 (五) 氨的代谢 1 体内有毒性的氨有三个重要来源 (1) 氨基酸脱氨基作用和胺类分解均可产生氨ꎮ RCH2NH2 胺氧化酶 →RCHO+NH3 (2) 肠道细菌腐败作用产生氨ꎮ (3) 肾小管上皮细胞分泌的氨:主要来自谷氨酰胺ꎮ 谷氨酰胺 谷氨酰胺酶 →谷氨酸+NH3 → H2O 2 氨的转运———在血液中以丙氨酸和谷氨酰胺 的形式转运氨 (1) 丙氨酸 ̄葡萄糖循环:氨从肌肉转运至肝ꎮ 1) 循环途径:肌肉中的氨基酸经转氨基作用将 氨基转给丙酮酸生成丙氨酸ꎻ丙氨酸经血液运送到 肝ꎮ 在肝中ꎬ丙氨酸通过联合脱氨基作用ꎬ释放出氨ꎬ 用于尿素合成ꎮ 转氨基后生成的丙酮酸可经糖异生 生成葡萄糖ꎮ 葡萄糖由血液输送到肌肉组织ꎬ沿糖分 解途径转变成丙酮酸ꎬ后者接受氨基生成丙氨酸ꎮ 此 为丙氨酸 ̄葡萄糖循环(图 7 ̄ 6)ꎮ 2) 生理意义:使肌中的氨以无毒的丙氨酸形式 运送到肝ꎬ同时ꎬ肝又为肌肉提供了葡萄糖ꎮ 图 7 ̄ 6 丙氨酸 ̄葡萄糖循环 (2) 谷氨酰胺的运氨作用:氨从脑和肌肉等组织 运往肝或肾ꎮ 1) 反应过程 2) 生理意义:谷氨酰胺既是氨的解毒产物ꎬ也是 氨的储存及运输形式ꎮ 3 氨在体内的去路 (1) 氨在体内的主要去路———氨在肝中合成尿素ꎮ 1) 尿素循环的提出:氨在肝中合成尿素的过程 由 Hans Krebs 和 Kurt Henseleit 提出ꎬ称为鸟氨酸循环 (orinithine cycle)ꎬ又称尿素循环(urea cycle)或 Krebs ̄ Henseleit 循环ꎮ 2) 反应步骤:尿素循环的过程见图 7 ̄7ꎮ A NH3、CO2和 ATP 缩合生成氨基甲酰磷酸:反应在 线粒体中进行ꎮ 反应由氨基甲酰磷酸合成酶Ⅰ(CPS ̄Ⅰ)催 化ꎬN ̄乙酰谷氨酸为其激活剂ꎬ反应消耗 2 分子 ATPꎮ B 氨基甲酰磷酸与鸟氨酸反应生成瓜氨酸:反 应由鸟氨酸氨基甲酰转移酶催化ꎮ 反应在线粒体中 进行ꎬ瓜氨酸生成后进入胞液ꎮ C 瓜氨酸与天冬氨酸反应生成精氨酸代琥珀 酸:反应在胞液中进行ꎮ D 精氨酸代琥珀酸裂解生成精氨酸和延胡索 酸:反应在胞液中进行ꎮ E 精氨酸水解释放尿素并再生成鸟氨酸:反应 在胞液中进行ꎮ