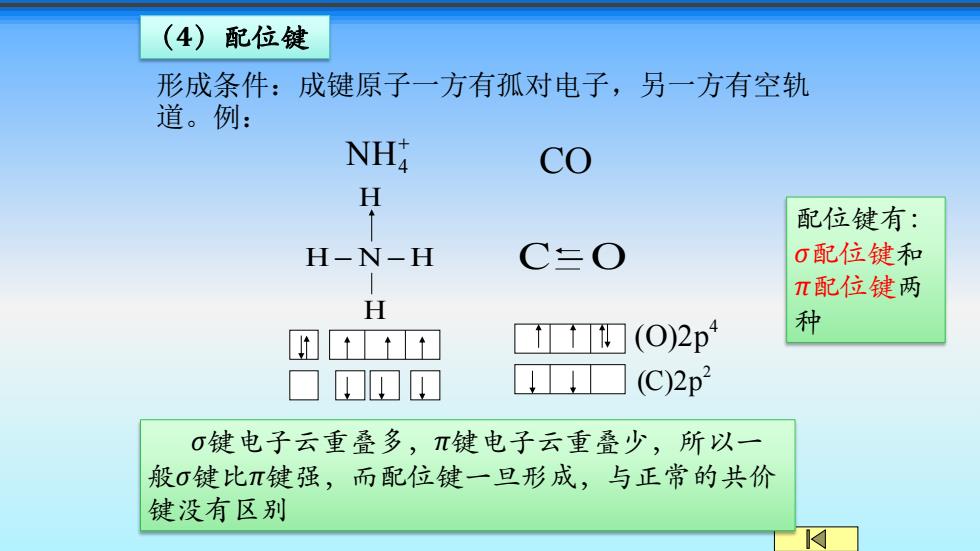
(4)配位键 形成条件:成键原子一方有孤对电子,另一方有空轨 道。例: NH2 co H 配位键有: H-N-H C三O 0配位键和 π配位键两 H (O)2p4 种 (C)2p2 0键电子云重叠多,π键电子云重叠少,所以一 般σ键比π键强,而配位键一旦形成,与正常的共价 键没有区别
形成条件:成键原子一方有孤对电子,另一方有空轨 道。例: + NH4 CO 2 (C)2p 4 (O)2p H − N − H H H C−O σ键电子云重叠多,π键电子云重叠少,所以一 般σ键比π键强,而配位键一旦形成,与正常的共价 键没有区别 (4)配位键 配位键有: σ配位键和 π配位键两 种

价健理论的局限性 C的电子结构1s22s22p2,其价电子结构: /A 只有两个未成对电子,只能形成两个共价键,且键角应为90左 右。但实际上,C可以与H形成4个CH共价键,且键角为10928’。 这是价键理论无法解释的。 为解决这一问题,Pauling提出了杂化轨道理论(hybridization), 丰富和发展了价键理论
C的电子结构1s22s22p2,其价电子结构: 只有两个未成对电子,只能形成两个共价键,且键角应为90。左 右。但实际上,C可以与H形成4个C-H共价键,且键角为109。28’。 这是价键理论无法解释的。 为解决这一问题,Pauling提出了杂化轨道理论(hybridization), 丰富和发展了价键理论。 价键理论的局限性

9.2.2杂化轨道理论 在同一原子中能量相近的不同类型(spd.)的几个原子 轨道波函数可以相互叠加而形成同等数目的能量完全 相同的杂化原子轨道。其基本要点: 1.成键时能级相近(一般是同一个能级组)的价电子 轨道相混杂,形成新的价电子轨道一一杂化轨道; 2.杂化前后轨道数目不变; 3.杂化后轨道伸展方向,形状发生改变
在同一原子中能量相近的不同类型(spd….)的几个原子 轨道波函数可以相互叠加而形成同等数目的能量完全 相同的杂化原子轨道。其基本要点: 9.2.2 杂化轨道理论 1. 成键时能级相近(一般是同一个能级组)的价电子 轨道相混杂,形成新的价电子轨道——杂化轨道; 2. 杂化前后轨道数目不变; 3. 杂化后轨道伸展方向,形状发生改变
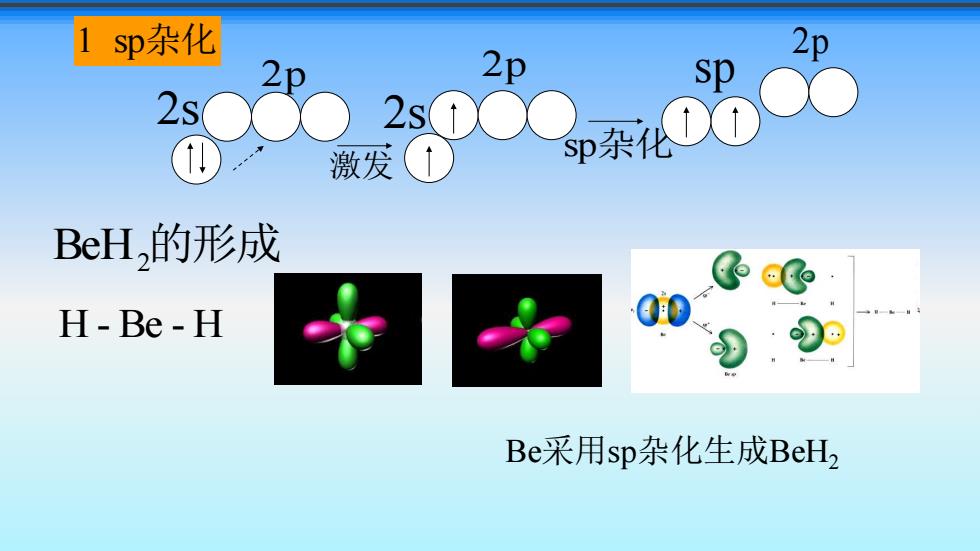
1sp杂 2p 2200b 2p sp 激发(1》 BeH,的形成 H-Be-H Be采用sp杂化生成BeH2
1 sp杂化 BeH2 的形成 激发 2s 2p 2s 2p sp杂化 sp 2p H - Be - H Be采用sp杂化生成BeH2
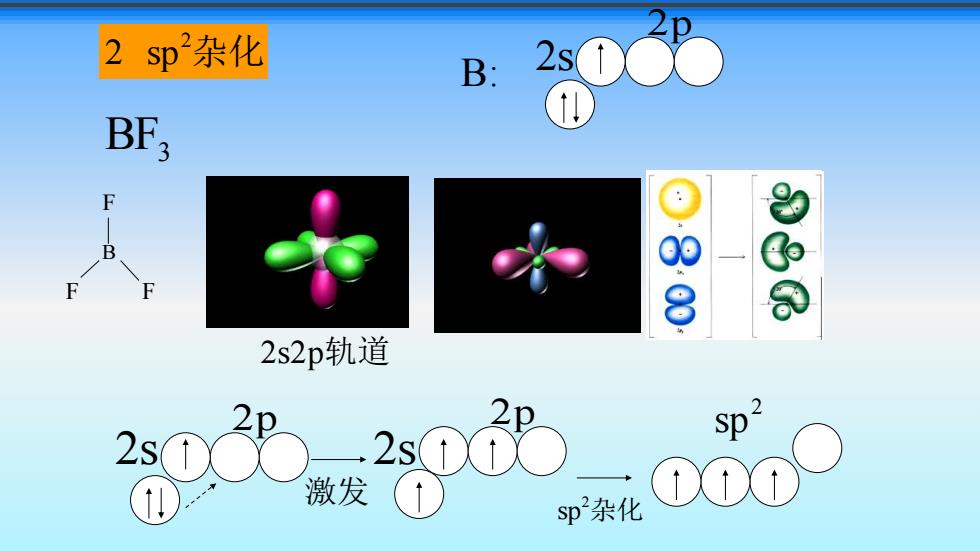
2sp杂化 B: 2s03 BF3 F .8 2s2p轨道 2 Sp 激发 sp杂化
BF3 B F F F 2 sp2 杂化 2s2p轨道 2s 2p B: sp2 杂化 2s 2p 2s 2p 激发 2 sp