
B.中心离子内层d轨道未充满,但配体(F,H0,0H)的配位原子 电负性大,吸引电子能力强,对中心离子内层d电子排斥作用小, 不易使其电子重排,只能与外层轨道成键 例:FcH2063+ Ffe3+3d54s040 见课件 2.内轨型配离子的形成: A.中心离子本身具有空的内层d轨道,一般形成内轨型配离子。 如:Cr3+ 3d34s04p0 例:Cr(CN63 Cr3+:3d34s04p0 见课件 B.中心离子内层d电子在配体影响下激发,空出内层轨道杂化成 键,形成内轨型离子。 例:CuNH3)42+ Cu2+3d94s04p0 见课件 C.中心离子内层d电子在配体影响下重排,空出内层d轨道,形成 内轨型离子。 配体CN,CO:配位原子C电负性小,给出电子能力强,孤对电子对 中心离子内层d电子作用大,使其容易发生电子重排而空出内层d 轨道,形成内轨型配合物。 例:Fe(CN63-Fe3+3a54s04p0 见课件 3.杂化轨道与配离子空间构型 6
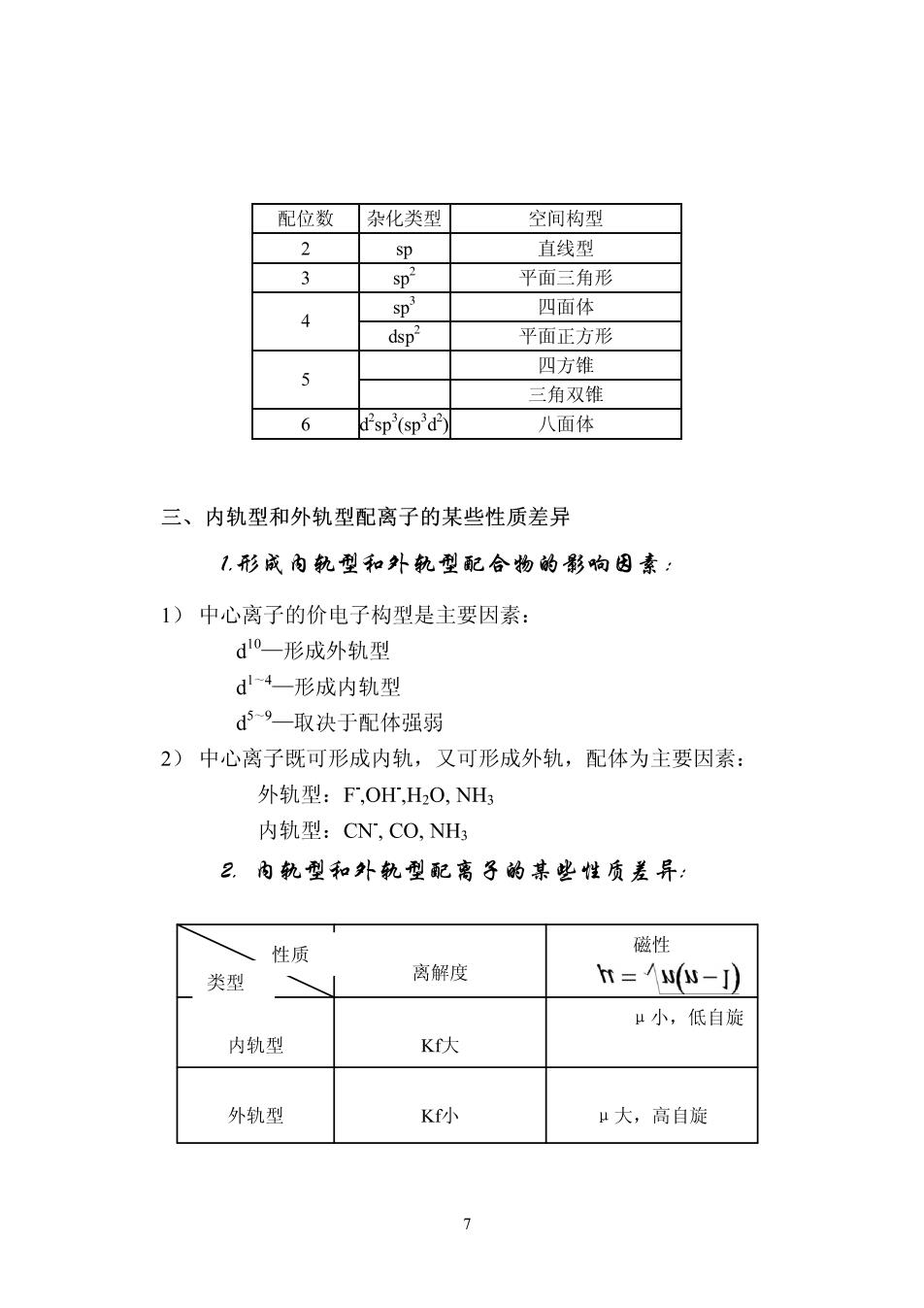
配位数杂化类型 空间构型 2 sp 直线型 3 sD 平面三角形 sp' 四面体 平面正方形 四方锥 三角双锥 6 d'sp'(sp'd) 八面体 三、内轨型和外轨型配离子的某些性质差异 1.形成内轨型和外轨型配合物的影响因素: 1)中心离子的价电子构型是主要因素: d0一形成外轨型 d4一形成内轨型 d9一取决于配体强弱 2)中心离子既可形成内轨,又可形成外轨,配体为主要因素: 外轨型:F,OH,HO,NH 内轨型:CN,CO,NH 2.内轨型和外轨型配离子的某些性质差异: 性质 磁性 类型 离解度 t=(-J) μ小,低自旋 内轨型 Kf大 外轨型 K小 μ大,高自旋 7

§8.3配位平衡 一、配离子的稳定常数 配离子或配合物分子在水溶液中存在着配合物的解离反应和生成 反应之间的平衡,这种平衡称为配位平衡。 1.稳定常数K:表示配离子在溶液中的稳定性的大小。 例: Ag"+2 NH3 位Ag(NHB)h 离解 配位平衡的平衡常数称配合物的稳定常数,用K表示.上述配 位平衡的稳定常数为: K,= c(Ag(NH,)) c(Ag")-c2(NH:) K愈大,配合物愈稳定.一般配合物的K数值均很大 2.配位反应是逐级进行的,每一级有相应的K。 例:Ag+NH3±AgNH3)+ Kno Ag(NH3)++NH3 Ag(NH3)2+K 配合物稳定常数是配合物在水溶液中离解稳定性的量度。对于 配位数相等的配离子,可根据K值的大小直接比较配离子的离解 稳定性,配位数不等的配离子之间,有时要通过计算才能比较。 例如,[CuY灯和[Cu(em2]2+的Kf值分别为5×1018和1.0×102, 8

实际上[CuY门比[Cu(en)z]2+更稳定。 3.配离子总的稳定常数等于各级稳定常数之积。 K-KnxK2 二、配位平衡的计算: 例:计算下列溶液中的浓度: 1.含有0.01 mol-LAg(NH)2*和0.01 molL"NH的溶液 2.含有0.01 mol-LAg(NH3)2和4 mol-L"NH的溶液 解: Ag+2NH,Ag(NH) 平衡x 0.01+2x 0.01-x k墙0a=1w 0.01 x=Ag+=5.9×106mol.L [NH3]=4molL,则Ag+=3.7×10mol.L 三、配位平衡的移动: 1.配位平衡与酸碱平衡 配合物中很多配体可接受质子,是碱。若配体碱性较强,溶 液中浓度又较大时,配体与质子结合,导致配离子离解。如 Cu(NH3)42+3d.0.5MH2SO4→天蓝色混浊+继续滴加0.5M H2SO,→混浊消失,溶液呈淡蓝色。 Cu(NH3)42*+2H*+2H2O-Cu(OH)2+4 NH" Cu(OH)2(s)+H2SO4-CuSO4+2H2O 这种因溶液浓酸度增大而导致配离子离解作用称为酸效应。 溶液酸度一定时,配体的碱性愈强,配离子愈不稳定。 配合物的中心原子大多是过渡金属离子,它们在水溶液中往 往会发生水解。溶液的碱性愈强,愈有利于水解的进行。这种因

金属离子与溶液中OH结合而使配离子离解的作用称为水解效应。 如 FeF3+3OH=6F+Fe(OH)3 为使配离子稳定,从水解效应考虑,pH值愈低愈好;从酸效 应考虑,则PH值愈高愈好。在一定酸度下,究竟是配位反应为主, 还是水解反应为主,或者是矿与配体结合成弱酸碱反应为主,这 要由配离子的稳定性、配体碱性强弱和中心原子氢氧化物的溶解 度等因素综合考虑,一般采取在不生成氢氧化物沉淀的前提下提 高溶液pH值的办法,以保证配离子的稳定性。 2配位平衡与沉淀平衡 AgCI溶液中加入NH3H2O,溶液中同时存在的AgC1沉淀 平衡和AgNH3)2配位平衡,即C和NH3竞争Ag: AgCl==Ag++CI- 十 2NH3 Ag(NH3)2 总反应:AgC1+2NH3=AgNH3)2+CI 竞争平衡常数K; K,-4g(NH):]Cr-] NH. =K·Kp 10