
或者写作 v=-1.des=-1.der=1.deo=1.den e dt f dt g dt h dt 对于某一化学反应,如果用各组分的浓度随时间的变化率来表示 反应速率,那么反应速率的值可能会各不相同,但一定符合上面的关 系式。在实际中,反应物或者产物,哪一个容易测定,就用哪一个的 浓度随时间的变化率表示该反应的速率
dt dc dt h dc dt g dc dt f dc e v E F G H = − = − = = 1 1 1 1 或者写作 对于某一化学反应,如果用各组分的浓度随时间的变化率来表示 反应速率,那么反应速率的值可能会各不相同,但一定符合上面的关 系式。在实际中,反应物或者产物,哪一个容易测定,就用哪一个的 浓度随时间的变化率表示该反应的速率
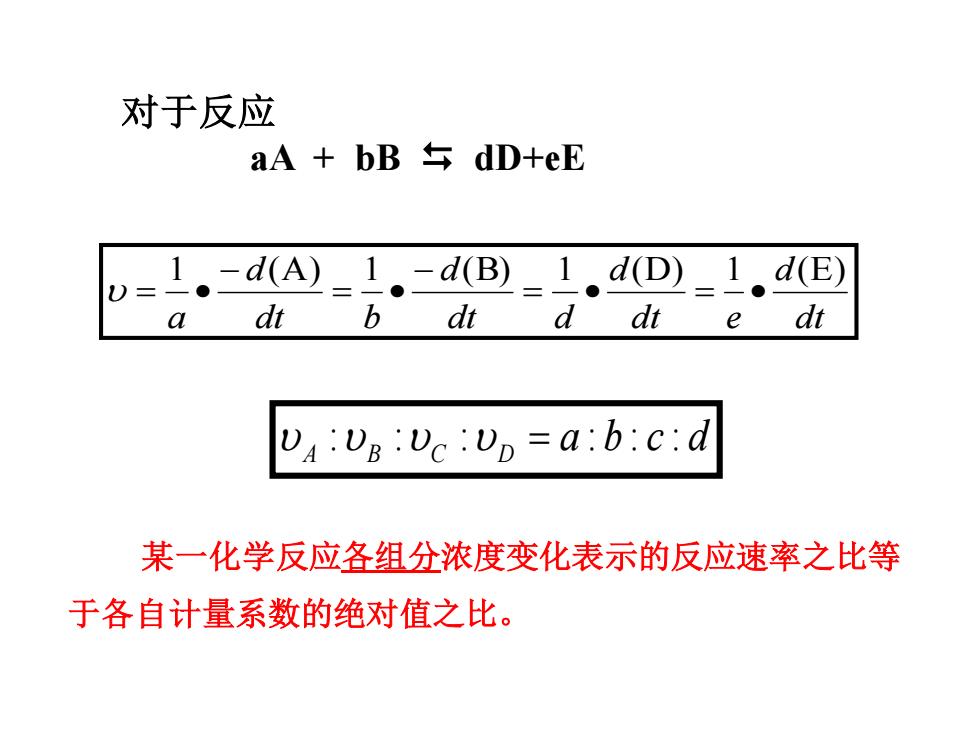
对于反应 aA+bB台dD+eE D=1.-dA=L.-dB)_1,dD_1,dE) a dt b dt d dt e dt UA:UB:Uc:Up=a:b:c:d 某一化学反应各组分浓度变化表示的反应速率之比等 于各自计量系数的绝对值之比
对于反应 aA + bB dD+eE dt d dt e d dt d d dt b d a 1 (A) 1 (B) 1 (D) 1 (E) = • = • − = • − = • a b c d A B C D : : : = : : : 某一化学反应各组分浓度变化表示的反应速率之比等 于各自计量系数的绝对值之比

二活化能与碰撞理论 化学反应的速率与反应物的本性有关,即与反应的活化能有关 -内因。 如何理解活化能的概念,目前提出了两种理论:碰撞理论和过 渡态理论
二 活化能与碰撞理论 化学反应的速率与反应物的本性有关,即与反应的活化能有关 -内因。 如何理解活化能的概念,目前提出了两种理论:碰撞理论和过 渡态理论

一、碰撞理论 1.活化能 ■反应是通过反应物分子彼此碰撞而发生的,其中 能发生的碰撞称为有效碰撞。 ■发生有效碰撞的分子称为活化分子。活化分子的 百分数越大,有效碰撞数越多,反应速率也越大
1. 活化能 ◼ 反应是通过反应物分子彼此碰撞而发生的,其中 能发生的碰撞称为有效碰撞。 ◼ 发生有效碰撞的分子称为活化分子。活化分子的 百分数越大,有效碰撞数越多,反应速率也越大。 一、碰撞理论
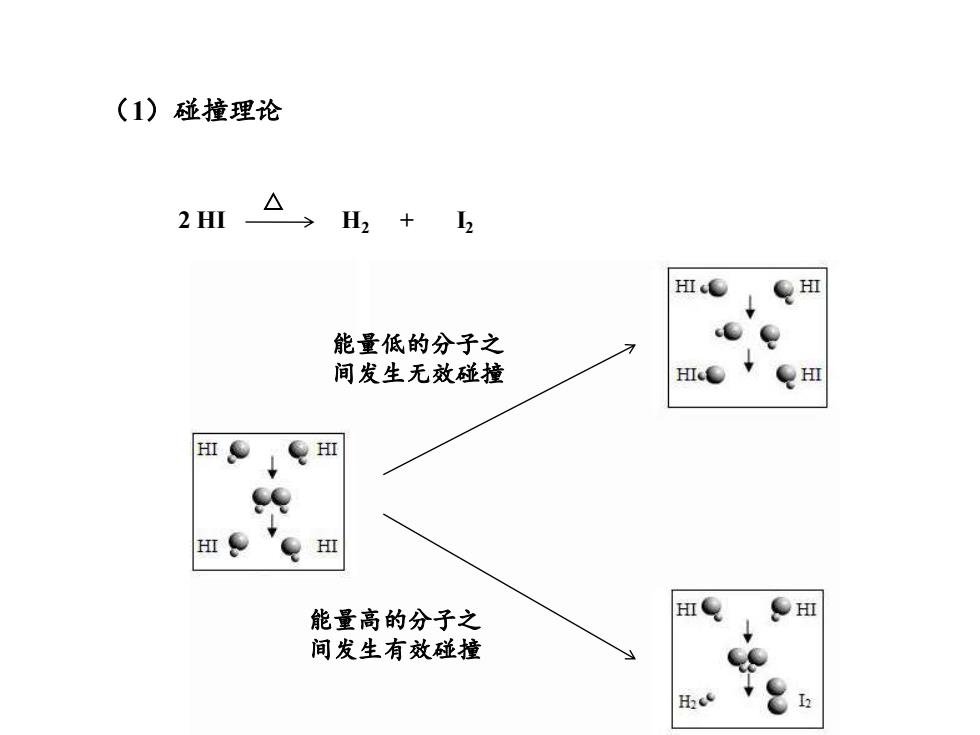
(1)碰撞理论 2 HI H2+ H 能量低的分子之 间发生无效碰撞 HI eHⅢ HI 能量高的分子之 HI HI 间发生有效碰撞
(1)碰撞理论 2 HI H2 + I2 △ 能量低的分子之 间发生无效碰撞 能量高的分子之 间发生有效碰撞