
11.1 化学动力学的任务和目的 三、化学动力学发展简史 第二个阶段,宏观反应动力学向微观反应动力学过渡阶 段.这个阶段主要是对于基元反应速率从理论上作了研 究.这个阶段的成就是路易斯1918年提出的分子碰撞理 论和1935年Eyring等提出过渡态理论。这个阶段的重 要发现是链反应。 第三阶段是微观反应动力学阶段,又叫分子反应动力 学阶段.在这个阶段中,使用了激光和分子束技术.这 个阶段的代表是李远哲等人1960年开始所做的交叉分 子束反应,李远哲等人1986年获诺贝尔化学奖
11.1 化学动力学的任务和目的 三、化学动力学发展简史 第二个阶段,宏观反应动力学向微观反应动力学过渡阶 段.这个阶段主要是对于基元反应速率从理论上作了研 究.这个阶段的成就是路易斯1918年提出的分子碰撞理 论和1935年 Eyring等提出过渡态理论。这个阶段的重 要发现是链反应。 第三阶段是微观反应动力学阶段,又叫分子反应动力 学阶段.在这个阶段中,使用了激光和分子束技术.这 个阶段的代表是李远哲等人1960年开始所做的交叉分 子束反应,李远哲等人1986年获诺贝尔化学奖

511.2化学反应速率表示法 口1.反应速度与速率 02.平均速率 ·3.瞬时速率 口4.反应进度 05.转化速率 06.反应速率 口7.绘制动力学曲线
§11.2 化学反应速率表示法 1.反应速度与速率 2.平均速率 3.瞬时速率 4.反应进度 5.转化速率 6.反应速率 7.绘制动力学曲线

511.2化学反应速率表示法 口1.反应速度与速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量,无方向性,都是正值。 本书用速率表示浓度随时间的变化。 例如: R→P 速度 dR]<0 dP]>0 dr dt 速率 -d[R] d[P] dt dt
§11.2 化学反应速率表示法 1.反应速度与速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量 ,无方向性,都是正值。 本书用速率表示浓度随时间的变化。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t − 速率 = 例如: R P ⎯⎯→
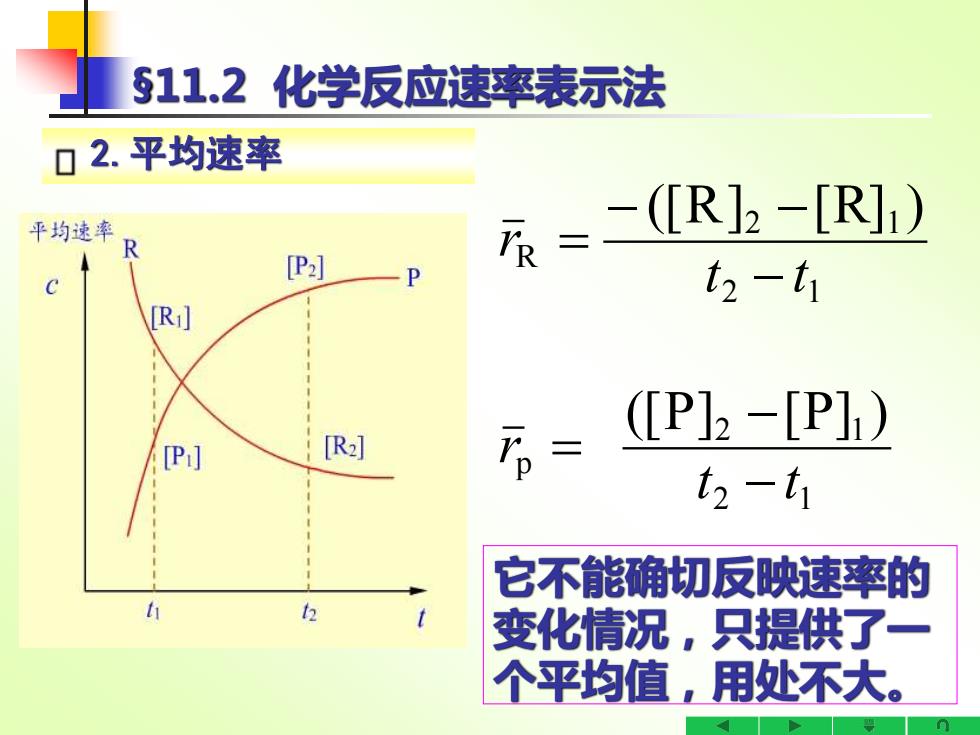
511.2化学反应速率表示法 口2.平均速率 平均速率 =-R2-R]) [P2] P t2-t1 [Ri P]2-[P]1) [P:] [R] t2-t1 它不能确切反映速率的 t 变化情况,只提供了一 个平均值,用处不大
§11.2 化学反应速率表示法 2.平均速率 2 1 2 1 p 2 1 2 1 R ([P] [P] ) ([R] [R] ) t t r t t r − − = − − − = 它不能确切反映速率的 变化情况,只提供了一 个平均值,用处不大

511.2化学反应速率表示法 口3.瞬时速率 d[P] 产物(P) R→P - R d[R] dt d[R] dr 反应物(R) 时间1 d[P] 反应物和产物的浓度随时间的变化 dt 在浓度随时间变化的图上,在时间t时,作交点的切线 就得到t时刻的瞬时速率。显然,反应刚开始,速率 大,然后不断减小,体现了反应速率变化的实际情况
§11.2 化学反应速率表示法 3.瞬时速率 t r t r d d[P] d d[R] R P p R = − = ⎯→ 在浓度随时间变化的图上,在时间t 时,作交点的切线, 就得到 t 时刻的瞬时速率。显然,反应刚开始,速率 大,然后不断减小,体现了反应速率变化的实际情况