
例3 计算1 mol.LHCI溶液中时用固体亚铁盐将 0.100mol·LK2Cr20,溶液还原一半时的电位。 E9c,0,2/cr3+=1.00V 解:0.100mol·LK2Cr20,溶液还原一半时 co,3-=0.0500mol/L cc=2×[0.1000-c6,o]=0.100mo1/L E60,c=Ec0,2G+ 0.0592 Cr20,2 6 lg c'cr" =1.01V 2024-10-1
2024-10-1 21 计算 溶液中时用固体亚铁盐将 0.100mol·L-1K2Cr2O7溶液还原一半时的电位。 解: 0.100mol·L-1K2Cr2O7溶液还原一半时 1mol L HCl 1 V c c E E 1.01 lg 6 0.0592 3 2 2 7 2 3 2 3 2 7 2 7 Cr 2 Cr O Cr O Cr Cr O Cr Cr2O7 2 Cr 3 1.00V E c c mol L c mol L Cr Cr O Cr O 2 [0.1000 ] 0.100 / 0.0500 / 2 2 7 3 2 2 7

6,1.3氧化还原反应的方向 在标准状态下,氧化还原反应可根据反应中两 个电对的标准电极电位(或条件电位)的大小 ,或通过有关氧化还原电对的电极电位来判断 反应的方向;在非标准状态下,由于外界条件 (如浓度、酸度等)发生变化时,氧化还原电 对的电极电位也将随之改变,故有可能改变氧 化还原的方向。 1、浓度对氧化还原反应方向的影响; 2、酸度对氧化还原反应方向的影响。 2024-10-1
2024-10-1 22 在标准状态下,氧化还原反应可根据反应中两 个电对的标准电极电位(或条件电位)的大小 ,或通过有关氧化还原电对的电极电位来判断 反应的方向;在非标准状态下,由于外界条件 (如浓度、酸度等)发生变化时,氧化还原电 对的电极电位也将随之改变,故有可能改变氧 化还原的方向。 1、浓度对氧化还原反应方向的影响; 2、酸度对氧化还原反应方向的影响
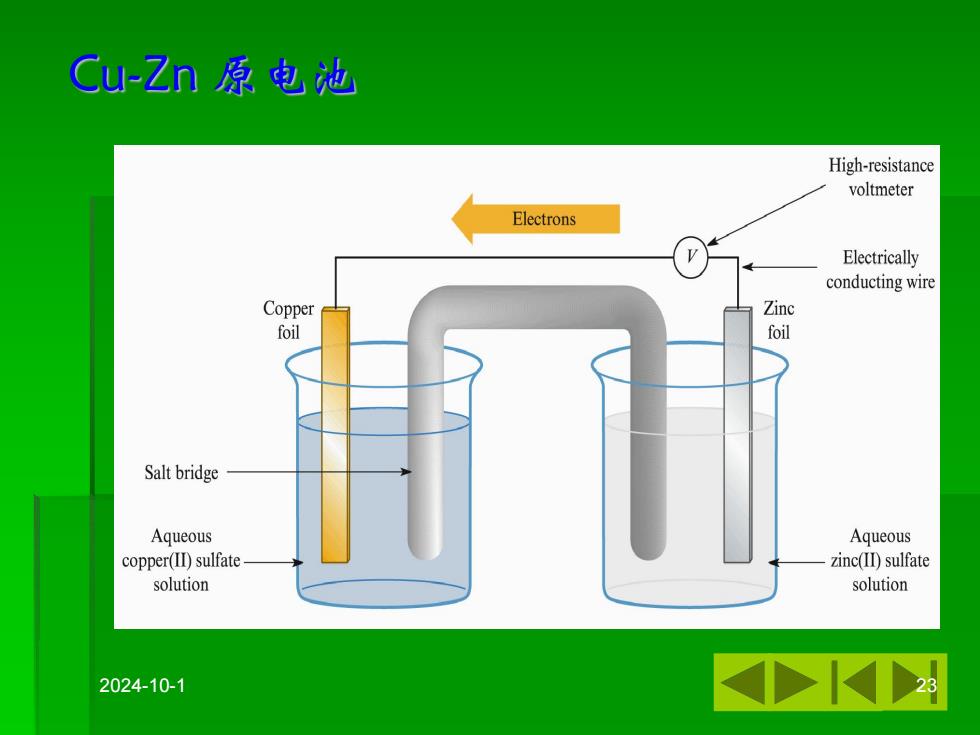
Cu-Zn原电池 High-resistance voltmeter Electrons Electrically conducting wire Copper Zinc foil foil Salt bridge Aqueous Aqueous copper(II)sulfate zinc(ID)sulfate solution solution 2024-10-1
2024-10-1 23

6.1.4氧化还原反应进行的程度 滴定分析要求化学反应必须定量地进 行,并尽可能地进行完全。氧化还原反应 进行的完全程度可以通过计算一个反应达 到平衡时的平衡常数或条件平衡常数的大 小来衡量,可以根据能斯特方程由两个电 对的标准电极电位或条件电位来求得。 n201+n1R2=n102+n2R1 202410-1
2024-10-1 24 滴定分析要求化学反应必须定量地进 行,并尽可能地进行完全。氧化还原反应 进行的完全程度可以通过计算一个反应达 到平衡时的平衡常数或条件平衡常数的大 小来衡量,可以根据能斯特方程由两个电 对的标准电极电位 或条件电位来求得。 n2O1+n1R2=n1O2+n2R1

续前 由标准电极电位→K,由条件电位→K'(条件平衡常数) Ox1+ne÷ Red Red2±Ox2+ne E, 20=Er+0059 n E,=Eg+1g。02=Eg+0059C n, 2024-10-1
2024-10-1 25 Ox1 + ne Red1 Red2 Ox2 + ne 1 1 1 1 1 Re ' 1 1 Re 1 1 lg 0.059 lg 0.059 d Ox d Ox C C n E a a n E E 2 2 2 2 Re ' 2 Re 2 2 2 2 lg 0.059 lg 0.059 d Ox d Ox C C n E a a n E E