
导 5.从水解平衡的角度解释用加入MgO的方法来除去MgC1,溶 液中的Fe3+。 答案:Fe3+水解:Fe3++3H,0=Fe(OHD3+3H+,加入MgO后, MgO与H+反应,cH)减小,平衡向右移动,使Fe3+生成Fe(OHD3 沉淀,从而除去溶液中的Fe3+
导航 5.从水解平衡的角度解释用加入MgO的方法来除去MgCl2溶 液中的Fe3+ 。 答案:Fe3+水解:Fe3++3H2O Fe(OH)3+3H+ ,加入MgO后, MgO与H+反应,c(H+ )减小,平衡向右移动,使Fe3+生成Fe(OH)3 沉淀,从而除去溶液中的Fe3+

导航 课堂·重难突破 一} 影响盐类水解的主要因素 重难归纳 1.内因。 主要因素是盐本身的性质,生成盐的弱酸酸性越弱,或生成 盐的弱碱碱性越弱,盐的水解程度越大(越弱越水解)。例如: 酸性CH,COOH>HCIO,则水解能力NaCIO>CHCOONa;相 同温度下,相同浓度的NaCIO溶液的pH大于CHCOONa溶液 的pH
导航 一 影响盐类水解的主要因素 重难归纳 1.内因。 主要因素是盐本身的性质,生成盐的弱酸酸性越弱,或生成 盐的弱碱碱性越弱,盐的水解程度越大(越弱越水解)。例如: 酸性CH3COOH>HClO,则水解能力NaClO>CH3COONa;相 同温度下,相同浓度的NaClO溶液的pH大于CH3COONa溶液 的pH。 课堂·重难突破
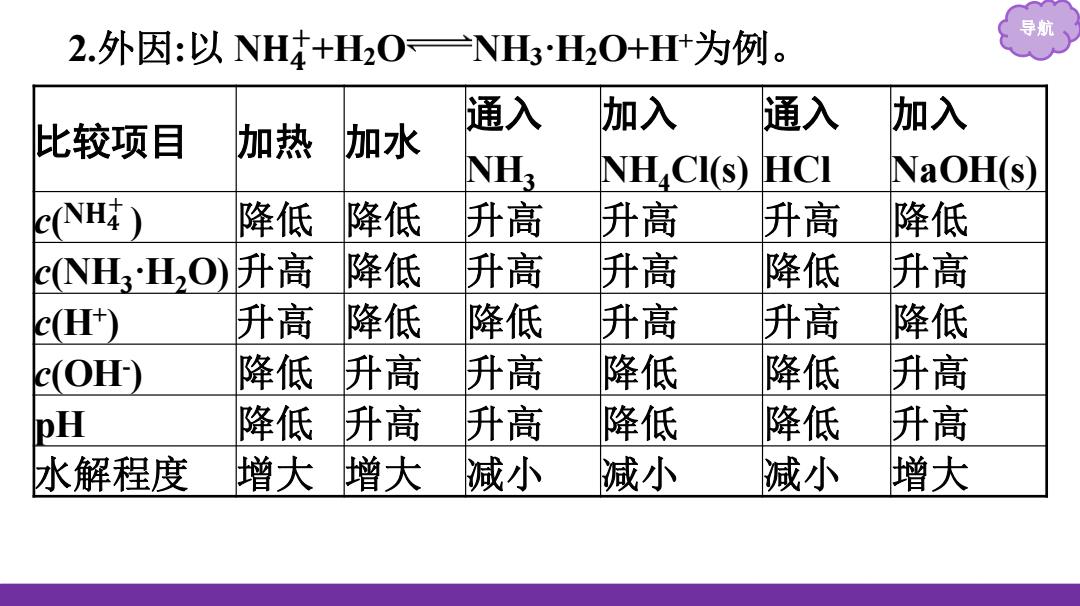
导则 2.外因:以NH4+H2O=NHH20+H+为例。 通入 加入 通入 加入 比较项目 加热。 加水 NH; NH CIS) HCI NaOH(s) C(NH 降低 降低 升高 升高 升高 降低 cNHH,O)升高 降低 升高 升高 降低 升高 cH) 升高 降低 降低 升高 升高 降低 c(OH) 降低 升高 升高 降低 降低 升高 pH 降低 升高 升高 降低 降低 升高 水解程度 增大增大 减小 减小 减小 增大
导航 2.外因:以 N𝐇𝟒 + +H2O NH3·H2O+H+ 为例。 比较项目 加热 加水 通入 NH3 加入 NH4Cl(s) 通入 HCl 加入 NaOH(s) c( ) 降低 降低 升高 升高 升高 降低 c(NH3·H2O) 升高 降低 升高 升高 降低 升高 c(H+ ) 升高 降低 降低 升高 升高 降低 c(OH- ) 降低 升高 升高 降低 降低 升高 pH 降低 升高 升高 降低 降低 升高 水解程度 增大 增大 减小 减小 减小 增大 N𝐇𝟒 +

导则 ?情境体验 NH,C溶液加水稀释,水解程度增大,溶液酸性增强,对吗? 提示:不对。加水稀释,水解程度增大,水解产生的H)增大, 但盐溶液的体积也增大,且体积增大对溶液酸性的影响比 H)增大对酸性的影响大。所以加水稀释,NH,CI溶液的酸 性减弱
导航 NH4Cl溶液加水稀释,水解程度增大,溶液酸性增强,对吗? 提示:不对。加水稀释,水解程度增大,水解产生的n(H+ )增大, 但盐溶液的体积也增大,且体积增大对溶液酸性的影响比 n(H+ )增大对酸性的影响大。所以加水稀释,NH4Cl溶液的酸 性减弱

典例剖析 FeCl,的水解方程式可写为FeCL+3H2O一Fe(OHD3+3HCl, 若增大水解程度,可采取的方法是()。 A.降温 B.加入饱和食盐水 C加入少量盐酸 D.增加FeCl3的浓度 答案:B 解析:A项,FeCl3的水解吸热,降温会使FeCL3的水解程度减 小;B项,FeCl3溶液被稀释,FeCl3的水解程度增大;C项,加入少 量盐酸抑制FeCl3的水解,FeCl的水解程度减小;D项,FeCl的 水解程度减小
典例剖析 导航 FeCl3的水解方程式可写为FeCl3+3H2O Fe(OH)3+3HCl, 若增大水解程度,可采取的方法是( )。 A.降温 B.加入饱和食盐水 C.加入少量盐酸 D.增加FeCl3的浓度 答案:B 解析:A项,FeCl3的水解吸热,降温会使FeCl3的水解程度减 小;B项,FeCl3溶液被稀释,FeCl3的水解程度增大;C项,加入少 量盐酸抑制FeCl3的水解,FeCl3的水解程度减小;D项,FeCl3的 水解程度减小