
第一章化学反应的热效应 第一节 反应热 素养·目标定位 目标素养 知识概览 1.认识化学能可以与热能等其他形式能量相互转化,能 量的转化遵循能量守恒定律。知道内能是体系内物质 定义、符号、单位 的各种能量的总和,受温度、压强、物质的聚集状态的 反应执 影响。 焓变 中和反应反应热的测定 2.了解反应热的概念,通过教材中的“中和反应反应热的 从微观角度分析反应热的实质 测定”实验,掌握反应热的测定方法。 3.了解反应热与焓变的关系,能从微观角度认识化学反 应 意义 应中能量变化的主要原因,能进行△H的有关计算。 表达方式 热 热化学方程式 4.认识热化学方程式的意义并能正确书写热化学方 书写要求 程式。 5.理解燃烧热的定义,掌握表示物质燃烧热的热化学方 燃烧热 含义 程式的书写。 第1课时 反应热 焓变 课前·基础认知 自主预习 2.焓与焓变。 与内能有关的物理量, 一、化学反应的实质与特征 用符号“H”表示 1.实质。 反应物中化学键断裂和生成物中化学键形成。 定义生成物与反应物的焓值差 2.特征。 焓变 符号用△H表示 既有物质变化,又伴有能量变化:能量转化主要表 单位 现为热量的变化。 常用kJ·moll或kJ/mol表示 :微思考1●化学反应是否一定有能量变化?有能 3.反应热与焓变的关系。 量变化的过程是否一定是化学变化? 比较项目 反应热 焓变(△H) 提示化学反应一定有能量变化:但有能量变化的过程 不一定是化学变化,如液态水吸收热量变为水蒸气,有能量 化学反应中生成物所具有 变化但不属于化学变化。 含义 化学反应中放出 的焓与反应物所具有的 或吸收的热量 二、反应热与焓变 焓之差 1反应热。 (1)定义:等温条件下,化学反应体系向环境释放或从环 △H是化学反应在恒定压强下(即敞口容器中 境吸收的热量,称为化学反应的热效应,简称反应热。 两者的相 进行的化学反应)且不与外界进行电能、光能 (2)单位:k·mol-1。 互联系 等其他能量的转化时的反应热,即恒定条件下 进行的反应的反应热等于反应的焓变
第一章 化学反应的热效应 第一节 反应热 素养·目标定位 目 标 素 养 知 识 概 览 1.认识化学能可以与热能等其他形式能量相互转化,能 量的转化遵循能量守恒定律。知道内能是体系内物质 的各种能量的总和,受温度、压强、物质的聚集状态的 影响。 2.了解反应热的概念,通过教材中的“中和反应反应热的 测定”实验,掌握反应热的测定方法。 3.了解反应热与焓变的关系,能从微观角度认识化学反 应中能量变化的主要原因,能进行ΔH 的有关计算。 4.认识热化学方程式的意义并能正确书写热化学方 程式。 5.理解燃烧热的定义,掌握表示物质燃烧热的热化学方 程式的书写。 第1课时 反应热 焓变 课前·基础认知 自主预习 一、化学反应的实质与特征 1.实质。 反应物中化学键 断裂 和生成物中化学键 形成 。 2.特征。 既有 物质 变化,又伴有 能量 变化;能量转化主要表 现为 热量 的变化。 微思考 1 化学反应是否一定有能量变化? 有能 量变化的过程是否一定是化学变化? 提示 化学反应一定有能量变化;但有能量变化的过程 不一定是化学变化,如液态水吸收热量变为水蒸气,有能量 变化但不属于化学变化。 二、反应热与焓变 1.反应热。 (1)定义:等温条件下,化学反应体系向环境释放或从环 境吸收的热量,称为化学反应的热效应,简称 反应热 。 (2)单位:kJ·mol-1 。 2.焓与焓变。 3.反应热与焓变的关系。 比较项目 反应热 焓变(ΔH) 含义 化学反应中 放出 或 吸收 的热量 化学反应中生成物所具有 的 焓 与反应物所具有的 焓 之差 两者的相 互联系 ΔH 是化学反应在恒定压强下(即敞口容器中 进行的化学反应)且不与外界进行电能、光能 等其他能量的转化时的反应热,即恒定条件下 进行的反应的反应热 等于 反应的焓变 1

化学 选择性必修1化学反应原理 配人教版 微思考2●“反应热指的是化学反应过程中放出的 (3)焓是一个物理量,与内能有关。 ( 热量”,这句话对吗? 答案(1)×(2)×(3)/ 提示不对。化学反应中放出或吸收的热量都是反 2.下列说法正确的是()。 应热。 A.化学反应过程中的能量变化就是热能的变化 三、吸热反应与放热反应 B.放热反应在常温下一定很容易发生 1.图示。 C.反应是放热还是吸热,可根据反应物和生成物所具有 焓↑ 焓H)↑ 的总能量的相对大小判断 反应物 生成物 D.吸热反应在常温下一定不能发生 答案C △H<0 △>0 解析A项,化学反应过程中的能量变化除了热能外,也 可以是光能和电能;B项,放热反应在常温下不一定容易 发生,如C(s)与O2(g)在点燃条件下才能发生;D项,吸热 生成物 反应在常温下也能发生,如Ba(OH)2·8H2O晶体与 反应物 NH,CI的反应。 放热反应 吸热反应 3.下列过程中伴随的能量变化属于反应热的是()。 2.结论。 A.形成1molH一Cl放出的能量 当反应体系放热时,其焓减小,△H<0:当反应体 B.石墨转变成金刚石吸收的能量 系吸热时,其焓增大,△H>0。 C.Na变成Na*吸收的能量 3.常见的放热反应、吸热反应。 D.水蒸气变成液态水放出的能量 放热反应 吸热反应 答案B 解析反应热指反应过程中能量的变化。A项和C项不 ①所有的燃烧反应 ①大多数分解反应 属于化学反应:B项,石墨转化为金刚石是化学反应:D ②大多数化合反应 ②Ba(OH)2·8H2O与 项,状态的改变属于物理变化。 ③酸碱中和反应 NHCI的反应 4.在一定条件下A与B反应可生成C和D,其能量变化如 ④活泼金属与水或酸的反应 ③C与CO2或H,Og)的反应 下图: ⑤物质的缓慢氧化 A十B C+D 反应物总 发生反应A十B=C十D 生成物总 ·微思考3。“放热反应不需要加热,吸热反应必须 加热。”这种说法正确吗? 能量E, 能量E2 提示不正确。放热反应很多是需要加热的,如燃烧: 若E>E2,反应体系的总能量 (填“升高”或 有些吸热反应不需要加热,如Ba(OH)2·8H2O与NHC “降低”),为 (填“吸热”或“放热”)反应,其 原因是 的反应:即化学反应放热还是吸热与反应条件没有必然 联系。 答案降低放热反应物的部分内能通过化学反应转 预习检测 化为热能释放到环境中 1,判断正误,正确的画“√”,错误的画“×”。 解析对于放热反应,反应物总能量大于生成物总能量, (1)化学反应的反应热一定等于化学反应的焓变。( 反应过程中部分热能释放到环境中,使反应体系总能量 (2)任何反应的反应热都可通过实验直接测定。( 降低。 课堂 ·重难突破 中和反应反应热的测定 2.实验装置。 温度计 玻璃 重难归纳 搅拌器 1.实验原理。 内简 通过测量一定量的酸、碱溶液在反应前后的温度,计算 隔热层、 杯盖 反应放出的热量,由此求得中和反应的反应热。 外壳 简易量热计示意图
化 学 选择性必修1 化学反应原理 配人教版 微思考 2 “反应热指的是化学反应过程中放出的 热量”,这句话对吗? 提示 不对。化学反应中放出或吸收的热量都是反 应热。 三、吸热反应与放热反应 1.图示。 放热反应 吸热反应 2.结论。 当反应体系放热时,其焓 减小 ,ΔH < 0;当反应体 系吸热时,其焓 增大 ,ΔH > 0。 3.常见的放热反应、吸热反应。 放热反应 吸热反应 ①所有的燃烧反应 ②大多数化合反应 ③酸碱中和反应 ④活泼金属与水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应 ② Ba(OH)2 ·8H2O 与 NH4Cl的反应 ③C与CO2 或H2O(g)的反应 微思考 3 “放热反应不需要加热,吸热反应必须 加热。”这种说法正确吗? 提示 不正确。放热反应很多是需要加热的,如燃烧; 有些吸热反应不需要加热,如 Ba(OH)2·8H2O 与 NH4Cl 的反应;即化学反应放热还是吸热与反应条件没有必然 联系。 预习检测 1.判断正误,正确的画“√”,错误的画“×”。 (1)化学反应的反应热一定等于化学反应的焓变。( ) (2)任何反应的反应热都可通过实验直接测定。 ( ) (3)焓是一个物理量,与内能有关。 ( ) 答案 (1)× (2)× (3)√ 2.下列说法正确的是( )。 A.化学反应过程中的能量变化就是热能的变化 B.放热反应在常温下一定很容易发生 C.反应是放热还是吸热,可根据反应物和生成物所具有 的总能量的相对大小判断 D.吸热反应在常温下一定不能发生 答案 C 解析 A项,化学反应过程中的能量变化除了热能外,也 可以是光能和电能;B项,放热反应在常温下不一定容易 发生,如C(s)与O2(g)在点燃条件下才能发生;D项,吸热 反应在常温下也能发生,如 Ba(OH)2 ·8H2O 晶体与 NH4Cl的反应。 3.下列过程中伴随的能量变化属于反应热的是( )。 A.形成1molH—Cl放出的能量 B.石墨转变成金刚石吸收的能量 C.Na变成 Na+ 吸收的能量 D.水蒸气变成液态水放出的能量 答案 B 解析 反应热指反应过程中能量的变化。A项和C项不 属于化学反应;B项,石墨转化为金刚石是化学反应;D 项,状态的改变属于物理变化。 4.在一定条件下 A与B反应可生成C和 D,其能量变化如 下图: A+B 反应物总 能量E1 发生反应 A+BC+D → C+D 生成物总 能量E2 若E1>E2,反应体系的总能量 (填“升高”或 “降低”),为 (填“吸热”或“放热”)反应,其 原因是 。 答案 降低 放热 反应物的部分内能通过化学反应转 化为热能释放到环境中 解析 对于放热反应,反应物总能量大于生成物总能量, 反应过程中部分热能释放到环境中,使反应体系总能量 降低。 课堂·重难突破 一 中和反应反应热的测定 重难归纳 1.实验原理。 通过测量一定量的酸、碱溶液在反应前后的温度,计算 反应放出的热量,由此求得中和反应的反应热。 2.实验装置。 简易量热计示意图 2

第一章 化学反应的热效应 3.测量步骤。 反应物的 反应前体反应后体 绝热装置的准备一 减少热量损失 温度差 实验 温度/℃ 系的温度系的温度 量取反应物, 用NaOH稀溶液、稀盐酸作反应 次数 NaOH 测反应前温度 物,测其平均温度,记为 盐酸 溶液 t1/℃ t2/℃ (t2-t1)/℃ 混合反应物, 测反应后混合液的最高 25.5 25.0 25.25 28.5 3.25 测反应后温度 温度,记为t2 24.5 24.5 24.5 27.5 3.00 重复实验 减少实验误差 325.0 24,5 24.75 26.5 1.75 4数据处理。 (1)反应后溶液的比热容为4.18J·(g·℃)-1。请利 AH=- (mm1十m2)·c·(t2-t1)X10-3 用该学生测得的数据计算生成1molH2O时的反应热: n(H2O) △H= 其中(m1十m2)表示溶液质量,单位为g,c为比热容, (2)该学生测得的反应热数值比57.3kJ·mol c=4.18J·(g·℃)-1。 (填“高”或“低”)。 5.注意事项 (3)从下列因素中选出该学生产生实验误差的可能原因 项目 内容 A.溶液混合后未及时盖好量热计杯盖 实验 ①迅速反应,防止热量散失。②在测量反应混合液的 B.倾倒溶液太快,有少量溶液溅出 关键 温度时要随时读取温度值,记录下最高温度值 C,溶液混合后搅拌不够 D.未等温度升到最高值就记录温度计示数 ①温度计不要靠在容器壁上或接触容器底部。②温 E.用量筒量取盐酸体积时仰视读数 度计测量溶液温度后,测另一溶液温度之前要先洗 答案(1)-52.25kJ·mol-1 注意 涤。③不可将温度计当作搅拌器使用:玻璃搅拌器应 (2)低(3)ABCD 事项 匀速搅拌。④为保证盐酸被完全中和,碱的浓度应 解析根据实验数据可知,实验3中的数据是异常的, 稍大 应舍去。所以温度差的平均值是3.125℃,△H= 0.418△t 易错警示 kJ·mol= 0.025 ·mol1=-0.418×3.125 0.025 一52.25kJ·mol-,该学生测得反应热的数值比57.3k· (1)大量实验测得,在25℃和101kPa下, mo~1低。数值偏低,说明实验过程中有热量损失或者是 强酸的稀溶液与强碱的稀溶液发生中和反应生成1m0l 酸、碱有损失。E中实际量取盐酸的体积大于50mL,结果 H2O时,放出57.3k的热量。 应该是偏高,所以正确的答案为ABCD。 (2)化学反应的能量变化主要表现为热量变化,但 化学反应的能量变化并不完全是热量变化,还有光能、 学以致用 电能等。 1.为了测定酸碱中和反应的反应热,计算时至少需要的 数据是( )。 ①酸溶液的浓度和体积②碱溶液的浓度和体积 ?情境体验 ③比热容④反应后溶液的质量⑤生成水的物质的量 (1)装置中的玻璃搅拌器能否用铜制环形搅拌器代替? ⑥反应前后温度的变化⑦操作所需的时间 为什么? A.①②⑥⑦ B.①③④⑤ 提示不能。原因是铜制环形搅拌器易导热,造成实验 C.③④⑤⑥ D.①②③④⑤⑥⑦ 过程中热量损失 答案C (2)实验中为什么NaOH溶液浓度比盐酸浓度稍大? 解析根据计算公式△H=一m(溶液),:一X 提示NaOH溶液极易吸收空气中的CO2,因此,碱稍 n(H2O) 过量可以保证盐酸完全反应。 10-3k·mol-1可知,C项正确。 2.教材中在探究“中和反应反应热的测定”时,若用浓硫 典例剖析 酸代替盐酸,用醋酸代替盐酸或用氨水代替NaOH溶液,对 某学生为测定中和反应的反应热,取用50mL 结果分别会产生什么影响? 0.50mol·L-1的盐酸和50mL0.55mol·L的NaOH 提示浓硫酸溶解于水时放热,使所测△H偏小,即 溶液(密度都是1g·cm)。实验中测得的数据如下表 △H<一57.3kJ·mo1:弱酸、弱碱电离时要吸热,使所测 所示: △H偏大,即△H>-57.3k·mol-1
第一章 化学反应的热效应 3.测量步骤。 4.数据处理。 ΔH=- (m1+m2)·c·(t2-t1)×10-3 n(H2O) 其中(m1+m2)表示溶液质量,单位为g,c为比热容, c=4.18J·(g·℃)-1。 5.注意事项。 项目 内容 实验 关键 ①迅速反应,防止热量散失。②在测量反应混合液的 温度时要随时读取温度值,记录下最高温度值 注意 事项 ①温度计不要靠在容器壁上或接触容器底部。②温 度计测量溶液温度后,测另一溶液温度之前要先洗 涤。③不可将温度计当作搅拌器使用;玻璃搅拌器应 匀速搅拌。④为保证盐酸被完全中和,碱的浓度应 稍大 (1)大量实验测得,在25℃和101kPa下, 强酸的稀溶液与强碱的稀溶液发生中和反应生成1mol H2O时,放出57.3kJ的热量。 (2)化学反应的能量变化主要表现为热量变化,但 化学反应的能量变化并不完全是热量变化,还有光能、 电能等。 (1)装置中的玻璃搅拌器能否用铜制环形搅拌器代替? 为什么? 提示 不能。原因是铜制环形搅拌器易导热,造成实验 过程中热量损失。 (2)实验中为什么 NaOH 溶液浓度比盐酸浓度稍大? 提示 NaOH 溶液极易吸收空气中的 CO2,因此,碱稍 过量可以保证盐酸完全反应。 典例剖析 某学 生 为 测 定 中 和 反 应 的 反 应 热,取 用 50mL 0.50mol·L-1 的盐酸和50mL 0.55mol·L-1 的 NaOH 溶液(密度都是 1g·cm-3)。实验中测得的数据如下表 所示: 实验 次数 反应物的 温度/℃ 反应前体 系的温度 反应后体 系的温度 温度差 盐酸 NaOH 溶液 t1/℃ t2/℃ (t2-t1)/℃ 1 25.5 25.0 25.25 28.5 3.25 2 24.5 24.5 24.5 27.5 3.00 3 25.0 24.5 24.75 26.5 1.75 (1)反应后溶液的比热容为4.18J·(g·℃)-1。请利 用该学生测得的数据计算生成1molH2O 时的反应热: ΔH= 。 (2)该学生测得的反应热数值比57.3kJ·mol-1 (填“高”或“低”)。 (3)从下列因素中选出该学生产生实验误差的可能原因 。 A.溶液混合后未及时盖好量热计杯盖 B.倾倒溶液太快,有少量溶液溅出 C.溶液混合后搅拌不够 D.未等温度升到最高值就记录温度计示数 E.用量筒量取盐酸体积时仰视读数 答案 (1)-52.25kJ·mol-1 (2)低 (3)ABCD 解析 根据实验数据可知,实验3中的数据是异常的, 应舍 去。 所 以 温 度 差 的 平 均 值 是 3.125 ℃,ΔH = - 0.418Δt 0.025 kJ·mol-1= - 0.418×3.125 0.025 kJ· mol-1 = -52.25kJ·mol-1,该学生测得反应热的数值比57.3kJ· mol-1 低。数值偏低,说明实验过程中有热量损失或者是 酸、碱有损失。E中实际量取盐酸的体积大于50mL,结果 应该是偏高,所以正确的答案为 ABCD。 学以致用 1.为了测定酸碱中和反应的反应热,计算时至少需要的 数据是( )。 ①酸溶液的浓度和体积 ②碱溶液的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度的变化 ⑦操作所需的时间 A.①②⑥⑦ B.①③④⑤ C.③④⑤⑥ D.①②③④⑤⑥⑦ 答案 C 解析 根据计算公式 ΔH =- cm(溶液)·(t2-t1) n(H2O) × 10-3kJ·mol-1 可知,C项正确。 2.教材中在探究“中和反应反应热的测定”时,若用浓硫 酸代替盐酸,用醋酸代替盐酸或用氨水代替 NaOH 溶液,对 结果分别会产生什么影响? 提示 浓硫酸溶解于水时放热,使所测 ΔH 偏小,即 ΔH<-57.3kJ·mol-1;弱酸、弱碱电离时要吸热,使所测 ΔH 偏大,即ΔH>-57.3kJ·mol-1。 3
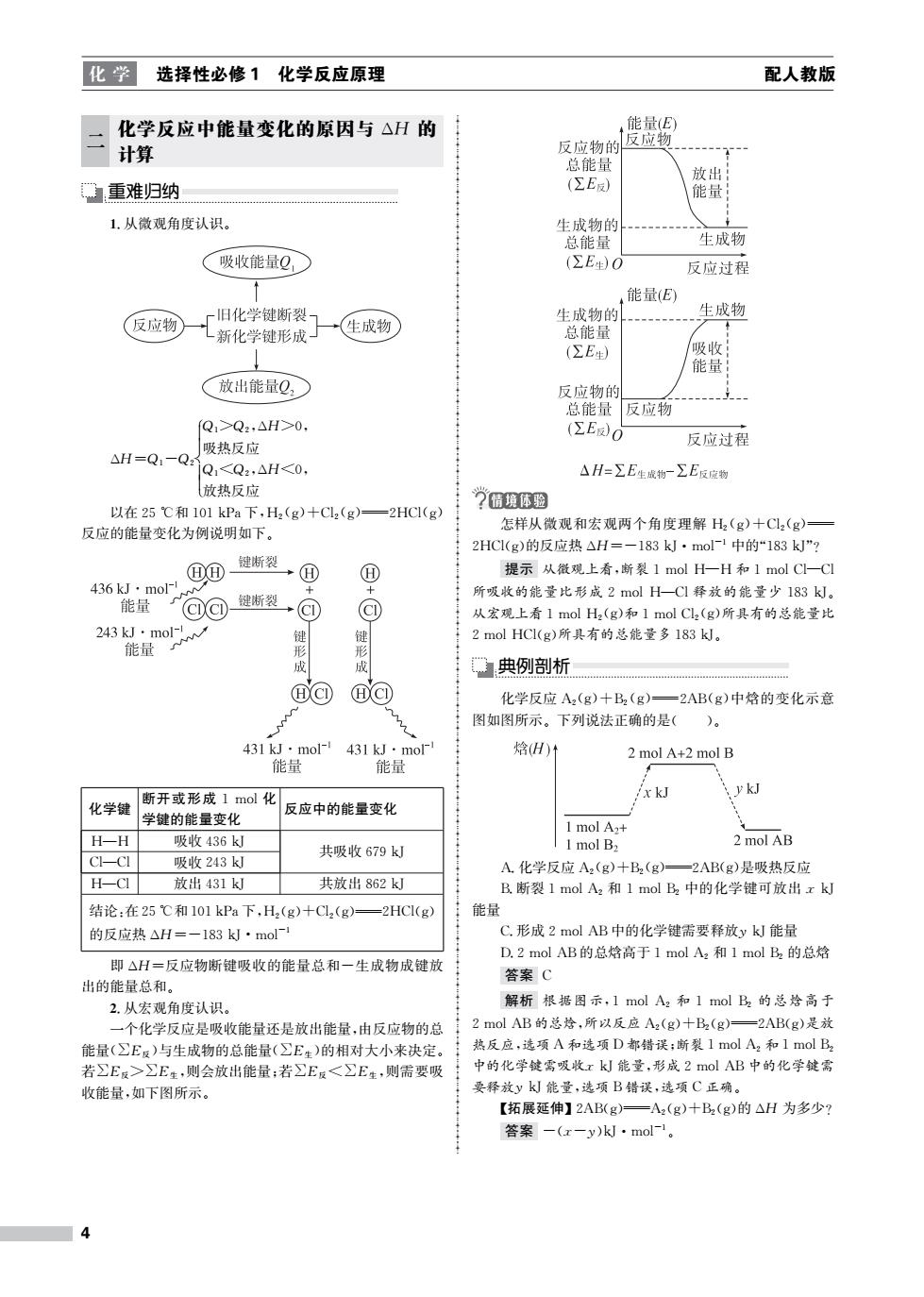
化学 选择性必修1化学反应原理 配人教版 化学反应中能量变化的原因与△H的 能量(E) 计算 反应物的 反应物 总能量 放出 重难归纳 (ΣE反) 能量 1.从微观角度认识。 生成物的 总能量 生成物 吸收能量Q, (∑E生)O 反应过程 能量(E) 旧化学键断裂 生成物的 生成物 反应物 新化学键形成 生成物 总能量 (∑E生) 吸收 能量 放出能量Q, 反应物的 总能量 反应物 Q1>Q2,△H>0. (ZEO 吸热反应 反应过程 △H=Qi-QQ,<Q2,△H<0, △H=∑E生成物一∑E反应物 放热反应 以在25℃和101kPa下,H2(g)+Cl2(g)- =2HCI(g) ”情境体型 反应的能量变化为例说明如下。 怎样从微观和宏观两个角度理解H2(g)十C12(g) 2HCl(g)的反应热△H=-183kJ·mol1中的“183k”? @④ 键晰裂 ① ① 提示从微观上看,断裂1molH一H和1molC一Cl 436kJ·mo 键断裂→ 所吸收的能量比形成2molH一CI释放的能量少183k。 能量 @①@ @ @ 从宏观上看1molH2(g)和1molC2(g)所具有的总能量比 243kJ·mol- 键 2 mol HCI(g)所具有的总能量多183kJ。 能量 形 成 典例剖析 BCI @C① 化学反应A2(g)十B2(g)一2AB(g)中焓的变化示意 图如图所示。下列说法正确的是( )。 431kJ·mol-1 431kJ·mo厂 焓H) 2 mol A+2 mol B 能量 能量 x kJ ykJ 断开或形成1mol化 化学键 反应中的能量变化 学键的能量变化 1 mol A2+ H-H 吸收436k 共吸收679kJ 1 mol B2 2 mol AB CI-CI 吸收243k A.化学反应A2(g)十B2(g)=2AB(g)是吸热反应 H-CI 放出431kJ 共放出862k B.断裂1molA2和1molB2中的化学键可放出xkJ 结论:在25℃和101kPa下,H2(g)十CL2(g)一2HCI(g) 能量 的反应热△H=-183k·mol- C.形成2 mol AB中的化学键需要释放yk能量 D.2 nol AB的总焓高于1molA2和1molB2的总焓 即△H=反应物断键吸收的能量总和一生成物成键放 答案C 出的能量总和。 2.从宏观角度认识。 解析根据图示,1molA2和1molB2的总焓高于 一个化学反应是吸收能量还是放出能量,由反应物的总 2 mol AB的总焓,所以反应A2(g)十B2(g)一2AB(g)是放 能量(∑E反)与生成物的总能量(∑E生)的相对大小来决定。 热反应,选项A和选项D都错误:断裂1molA2和1molB2 若∑E:>∑E生,则会放出能量:若∑E反<∑E生,则需要吸 中的化学键霄吸收xkJ能量,形成2olAB中的化学键需 收能量,如下图所示。 要释放yk能量,选项B错误,选项C正确。 【拓展延伸】2AB(g)—A2(g)十B2(g)的△H为多少? 答案-(x-y)kJ·mol-1
化 学 选择性必修1 化学反应原理 配人教版 二 化学反应中能量变化的原因与 ΔH 的 计算 重难归纳 1.从微观角度认识。 ΔH=Q1-Q2 Q1>Q2,ΔH>0, 吸热反应 Q1<Q2,ΔH<0, 放热反应 以在25℃和101kPa下,H2(g)+Cl2(g)2HCl(g) 反应的能量变化为例说明如下。 化学键 断开或形成1mol化 学键的能量变化 反应中的能量变化 H—H 吸收436kJ Cl—Cl 吸收243kJ 共吸收679kJ H—Cl 放出431kJ 共放出862kJ 结论:在25℃和101kPa下,H2(g)+Cl2(g)2HCl(g) 的反应热ΔH=-183kJ·mol-1 即ΔH=反应物断键吸收的能量总和-生成物成键放 出的能量总和。 2.从宏观角度认识。 一个化学反应是吸收能量还是放出能量,由反应物的总 能量(∑E反 )与生成物的总能量(∑E生 )的相对大小来决定。 若∑E反 >∑E生 ,则会放出能量;若∑E反 <∑E生 ,则需要吸 收能量,如下图所示。 怎样从微观和宏观两个角度理解 H2(g)+Cl2(g) 2HCl(g)的反应热ΔH=-183kJ·mol-1 中的“183kJ”? 提示 从微观上看,断裂1molH—H 和1molCl—Cl 所吸收的能量比形成2molH—Cl释放的能量少183kJ。 从宏观上看1molH2(g)和1molCl2(g)所具有的总能量比 2molHCl(g)所具有的总能量多183kJ。 典例剖析 化学反应 A2(g)+B2(g)2AB(g)中焓的变化示意 图如图所示。下列说法正确的是( )。 A.化学反应 A2(g)+B2(g)2AB(g)是吸热反应 B.断裂1molA2 和1molB2 中的化学键可放出xkJ 能量 C.形成2molAB中的化学键需要释放ykJ能量 D.2molAB的总焓高于1molA2 和1molB2 的总焓 答案 C 解析 根据图示,1molA2 和1molB2 的总焓高于 2molAB的总焓,所以反应 A2(g)+B2(g)2AB(g)是放 热反应,选项A和选项D都错误;断裂1molA2 和1molB2 中的化学键需吸收xkJ能量,形成2molAB中的化学键需 要释放ykJ能量,选项B错误,选项C正确。 【拓展延伸】2AB(g)A2(g)+B2(g)的ΔH 为多少? 答案 -(x-y)kJ·mol-1。 4

第一章化学反应的热效应 学以致用 2.键能是两气态原子间形成1mol新键(或其逆过程) 时释放(或吸收)的能量。已知下列化学键的键能: 1,由图分析,下列说法正确的是 焓H) B+C 化学键 H-H N=N N-H ( A.A→B十C和B十C→A两 个反应吸收或放出的能量不等 键能/(kJ·mol-1】 436 946 391 B.A→B十C为放热反应 则反应:N2(g)十3H2(g)=一2NH3(g)的△H= C.A具有的焓高于B和C具有的焓的总和 D.A→B十C的△H>0,则B十C→A的△H<0 答案-92kJ·mol-1 答案D 解析△H=反应物断键吸收的总能量一生成物成键 解析由图可看出,B和C的焓之和高于A的焓,则反 释放的总能量=946k·mol-1+3X436kJ·mol-1-6X 应B十C一A一定是放热反应,△H<0:反之, 391kJ·mol-1=(2254kJ·mol-1-2346kJ·mol-1)= A→B十C的反应一定是吸热反应,△H>0。根据能量守 -92kJ·mol-1。 恒定律,两反应吸收和放出的能量一定相等。 随堂训练 1,下列说法中不正确的是()。 系温度升高 A分解反应大多数是吸热反应 B.当反应放热时,体系内能增大 B.氢氧化钾与硝酸的反应是放热反应 C,在加热条件下发生的反应,体系的焓均增大 C.燃料有足够的空气就能充分燃烧 D.一个化学反应,当反应物的总焓小于生成物的总焓时, D.放热反应的过程,可以看成是“贮存”在物质内部的能 其△H为负值 量转化为热能、光能、电能等被释放出来的过程 答案A 答案C 解析体系与环境不进行能量传递时,反应放出的热量留 解析空气足量,若燃料与空气接触不充分,也不能充分 在体系中,体系的温度会升高,用量热计测定中和反应的 燃烧。 反应热时就是利用了这一原理,A项正确。反应放热时, 2.已知:①能量越低的物质就越稳定,②白磷转化成红磷是 能量从体系传递给环境,体系内能减小,B项错误。体系 放热反应。据此,下列判断或说法中正确的是( )。 熔的变化取决于反应物和生成物的总焓的相对大小,与反 A.在相同的条件下,红磷比白磷能量高 应条件无关,C项错误。当反应物的总焓小于生成物的总 B.在相同的条件下,白磷比红磷稳定 焓时,体系的捻增加,其△H为正值,D项错误。 C.红磷和白磷的结构不同 5.已知弱酸电离时会吸收能量。在中和反应反应热的测定 D.红磷容易发生自燃而白磷则不会自燃 实验中,下列说法正确的是()。 答案C A.使用玻璃搅拌器匀速搅拌是为了使酸与碱充分反应 解析由题意知,相同条件下,白磷能量高,红磷能量低, 提高测定结果的准确度 红磷比白磷稳定。 B.为了准确测定反应中混合溶液的最高温度,实验中要 3.下列化学反应的△H>0的是( )。 用温度计搅拌混合溶液 A2H,十0,点尴2H,0 C.若用0.5mol·L1NaOH溶液分别与0.5mol·L- 的盐酸、醋酸反应,当所取的溶液体积相等时,测得的 B.CaC0,授挠Ca0+CO,↑ 反应热数值相同 C.CaO+H2O=Ca(OH)2 D.在中和反应反应热的测定实验中只测量一次就能准确 D.C,H,0H+30,点槛2c0,十3H,0 得到实验结果 答案A 答案B 解析温度计不能用来搅拌溶液,易破损,B项错误; 解析选项B中的反应是吸热反应,其△H>0。选项A、 CH COOH电离时吸热,测得的反应热数值偏小,C项错 CD中的化学反应都是放热反应,其△H<0。 误;实验中一般测量3次,若有异常数据,舍弃后再取平均 4.下列说法正确的是()。 值作为计算依据,以提高准确度,D项错误。 A.体系与环境不进行能量传递时,反应放出的热量使体
第一章 化学反应的热效应 学以致用 1.由图分析,下列说法正确的是 ( )。 A.A →B+C和B+C →A两 个反应吸收或放出的能量不等 B.A →B+C为放热反应 C.A具有的焓高于B和C具有的焓的总和 D.A →B+C的ΔH>0,则B+C →A的ΔH<0 答案 D 解析 由图可看出,B和C的焓之和高于 A的焓,则反 应 B+ C → A 一 定 是 放 热 反 应,ΔH <0;反 之, A →B+C的反应一定是吸热反应,ΔH >0。根据能量守 恒定律,两反应吸收和放出的能量一定相等。 2.键能是两气态原子间形成1mol新键(或其逆过程) 时释放(或吸收)的能量。已知下列化学键的键能: 化学键 H—H N≡N N—H 键能/(kJ·mol-1) 436 946 391 则反应:N2(g)+3H2(g)2NH3(g)的 ΔH = 。 答案 -92kJ·mol-1 解析 ΔH=反应物断键吸收的总能量-生成物成键 释放的总能量=946kJ·mol-1+3×436kJ·mol-1-6× 391kJ·mol-1=(2254kJ·mol-1-2346kJ·mol-1)= -92kJ·mol-1。 随堂训练 1.下列说法中不正确的是( )。 A.分解反应大多数是吸热反应 B.氢氧化钾与硝酸的反应是放热反应 C.燃料有足够的空气就能充分燃烧 D.放热反应的过程,可以看成是“贮存”在物质内部的能 量转化为热能、光能、电能等被释放出来的过程 答案 C 解析 空气足量,若燃料与空气接触不充分,也不能充分 燃烧。 2.已知:①能量越低的物质就越稳定,②白磷转化成红磷是 放热反应。据此,下列判断或说法中正确的是( )。 A.在相同的条件下,红磷比白磷能量高 B.在相同的条件下,白磷比红磷稳定 C.红磷和白磷的结构不同 D.红磷容易发生自燃而白磷则不会自燃 答案 C 解析 由题意知,相同条件下,白磷能量高,红磷能量低, 红磷比白磷稳定。 3.下列化学反应的ΔH>0的是( )。 A.2H2+O2 点燃 2H2O B.CaCO3 煅烧 CaO+CO2↑ C.CaO+H2OCa(OH)2 D.C2H5OH+3O2 点燃 2CO2+3H2O 答案 B 解析 选项B中的反应是吸热反应,其ΔH>0。选项 A、 C、D中的化学反应都是放热反应,其ΔH<0。 4.下列说法正确的是( )。 A.体系与环境不进行能量传递时,反应放出的热量使体 系温度升高 B.当反应放热时,体系内能增大 C.在加热条件下发生的反应,体系的焓均增大 D.一个化学反应,当反应物的总焓小于生成物的总焓时, 其ΔH 为负值 答案 A 解析 体系与环境不进行能量传递时,反应放出的热量留 在体系中,体系的温度会升高,用量热计测定中和反应的 反应热时就是利用了这一原理,A 项正确。反应放热时, 能量从体系传递给环境,体系内能减小,B项错误。体系 焓的变化取决于反应物和生成物的总焓的相对大小,与反 应条件无关,C项错误。当反应物的总焓小于生成物的总 焓时,体系的焓增加,其ΔH 为正值,D项错误。 5.已知弱酸电离时会吸收能量。在中和反应反应热的测定 实验中,下列说法正确的是( )。 A.使用玻璃搅拌器匀速搅拌是为了使酸与碱充分反应, 提高测定结果的准确度 B.为了准确测定反应中混合溶液的最高温度,实验中要 用温度计搅拌混合溶液 C.若用0.5mol·L-1 NaOH 溶液分别与0.5mol·L-1 的盐酸、醋酸反应,当所取的溶液体积相等时,测得的 反应热数值相同 D.在中和反应反应热的测定实验中只测量一次就能准确 得到实验结果 答案 A 解析 温度计不能用来搅拌溶液,易破损,B 项错误; CH3COOH 电离时吸热,测得的反应热数值偏小,C项错 误;实验中一般测量3次,若有异常数据,舍弃后再取平均 值作为计算依据,以提高准确度,D项错误。 5