
:2“下面举侧说明如何利用平衡常数求出△g(和△G。 、例:当薄酸二羟丙与甘油酯3裤酸互变达到平衡时,甘油醛?-磷酿与碑酸二羟丙耐 浓度的比值是0.0475(25C),其反应条件为p丑-7。当达到平衡时甘袖醛8磷酸的浓度为 3×10-·摩尔,辞酸二羟丙酮的浓度为2×10摩尔,其△G‘值可由下式求得: .:5△%车r2.33×1.987×10×208×1g(09476):,:4 =-1.364×1g(0.0475) , 太1,81千卡/噬尔+7.7千焦魔尔,; 再由已知△G'值求出△G值。, AG=AGo+R1n甘 =1.812487-,0.677千卡/摩尔g101于焦/摩尔 由上面求出的AG为位(+1.9),而△为负值(0.67),因自安短应的荆断依 △G值,而不是△G'值,但△G值主要依赣于反应物的性质和他们的浓度(对数)。△仔值为负 值即反应能够自发进行。因此由磷酸二羟丙明变为甘油醛?醉酸的反应在上述浓座的条件 下可以自发进行。: 又例如,电1酸葡箭(其起始浓度为0.020摩尔浓度)向磷酸葡转,或由 6一磷酸葡萄糖(起始浓度为0.000峰尔浓度)向端酸葡萄糖转变,最后得到的混合物,无 论以哪个为起始物都含有0.00100摩尔浓度1酸葡萄糖和0.019摩尔浓度6酸葡萄能。 反应温度为,5口日一7。上述反应体系中有过量的脾酸葡萄德变位酶存在。.求出该反应的 =10.0,1· 裤酸箱萄朝】 D.1 △g2-230801g-2.308×1:987×0-9×298×1g1地.0 -1.36×1.28-1.74千卡/摩尔 4g-仁生.74+故10爵酸葡雪 -1.74+2:909×1,s7×10-×2a08x1g00e ,米只二1.74+05-1.4千卡/除尔+一又,80千熊/摩尔, △值为负德明:由(碑酸葡萄繁变为1骑酸葡萄黄的厌应可自发进行。酸葡移鹅 变位酶只起如速反应进行的作用,不影响反应的平衡点。, 从以上举创可清楚地看到△G和△G'是树个全然不词的值在自发进行的秘幸反应中 自由能总是在蒂低。A日总是负值丽悔一化学度应都有其特定的标准镇由能鹰化,即△心 值,·△G可能透正值,或等于:此植依赖反应的平衡常数。:从标自由变化△G 可得知当化学反应在标准状况下发生时,此反应在何处送到平衡。也就是说,当反应物的起始 为摩尔浓:p山气,温度为0时,:△是个常冀:是一个特疤算。而AG是-一给

定化学反应实的白由能变化。△G值是浓度、p日、温度的函数,随者这些条件的改变而变 化。而且△G对于所有趋向平衡的反应都是负值。而且此绝对值逐新缩小直至达到军为止,这 时反应即达到平衡点。 三、自由能变化的可加性及其在生物化学反应中的意义 在偶联的几个化学反应中,自由能的总变化等于每一步反应白由能变化的总和(参看公式 34)可举例如下: 例如果AB+C △G三+5手.卡/度尔《+0.92千化度乐 B.D △G"-8干卡/摩尔(-3.47千焦/摩尔》 斯A=20+DG=3卡/尔-125F点/尔) 在标准次况下,A不可能自发地转变为B和C,因△G是正值。然而B变为D在标准状 祝下是容易进行的,因△G为负值。因白由能变化是可加和的,由A变为0和D其△G'一 一3千卡/摩尔,于是此变化可以自发进行。这样,一个热力学上不能进行的反应,可以由与它 偶联的,热力学上容易进行的反应驱动,这种情况在生物化学反应中是很多的。 四、化学反应和自由能及之间关系的概括 在化学反应中,只有自由能降低(即△G仔<0)的反应才能自发地进行。反应进行的推动力 与自由能降低的多少成正比。当△G为正值时(△G>0)即反应产物的标准生戒自由能,大于 反应物的标准生成白由能,这种反应不能自发地进行。需要外界提供能量反应才能进行。这 种反应称为需能反应。 例如从无机磷酸形成焦磷酸的反应,其△G>0,(△G-37.7干焦耳)。即使向此反应体系 中加入纯酸等催化剂,仍不能使无机磷酸变为焦磷酸。而反方向的反应却可颗利去行。因为 焦磷酸水解为无机磷酸的自由能变化为一377千焦耳。 当一个反应处于平衡态时,没有自由能的变化(△G=0)。所以从处于平衡态的反应,不可 能得到能够做功的能。 热力学第二定律只指示过程的方向和限度,不预示过程的速率,故对于△G<0的化学反 应,也并不等于这个反应,实际上已经自发地进行。对许多反应还必须供给反应卧子以活化 能,或用催化剂来降低活化能反应才能进行就起若这种催化作用。 有机化合物所含的自由能主要决定于化合物中所含基团的能量。一般说来,不稳定的活浚 的化学基团常具有高的自由能。这种基团在化学反应中也具有大的反应势能或者说推动力。 五、标准生成自由能及其与平衡常数的关系 标准生成自由能就是由标准状态的最稳定单质合成标准状态化合物时的标准自由能变化 (△G)。事实上标准生成自由能的绝对值是无法由实轮测出的。但可利用自由能是状态函数 的性质,规定1大气压下,一定温度时最稳定单质的标准摩尔自由能为墨。这样,在标准状态 下,由稳定单质生成1摩尔纯化合物的△G°就$于此化合物的标准生成自由能。例如在标准 .16·

状态下(1大气压,26C)由耳,和0,形成H,0的过程,如果反应物H,和0,、产物耳,0的浓 度(活度)都是1,其自由能变化可由下式求得: 耳,(气)+二0()一→耳0(演) △0-60(侵6,+-%0-(合0+0) =G=-237.19千伟耳 由以上关系可以看出,水的标准生成自由能是以氢和氧的标准摩尔自由能为零作比较基准求 得的。 常见物质在25℃(298K)时的标准生成自由能多已列成表,载于化学手册中。在8I(y时 tem internatio加al)制中,标准生成自由能的单位是焦耳/摩尔或千焦耳/摩尔。 利用标准生成自由能数据就可计算在标准状态下一个反应进行时自由能的改交量。有了 反应的标准自由能值就可根据△G一一RT1K的公式求出平衡常数值。 .·第三节能量学在生物化学应用中的一些规定 ,能泽学用玉探讨生物化学反应必须考感生物体的特点。为了便于用能量学探讨在华命过 程中的化学反应原理,已作出一些规定,列举如下: :1.在任何情况下,在一个稀的水溶液系统中,当有水作为反应物戒产物时,水的活度(近 似的即浓度)规定为1.0虽然水的体积摩尔浓度实际上为的.5痿尔丹 2.在生物化学能量学(biochemioaltic)中,通常把标准状况的pH值规定为 7.0,因为生物化学反应大多是在p日-7.0的条件下进行的,而且柱往有丑离子的参入或释 敢。因此,.在p识为7.Q的条件下麻测得的自由能变化用△G”表示。这不同于物理化学中 以pH=0.0(即氧离子浓度为1.0摩尔/升)作为标准的自由能变化。=0.0时的标准自由 能变化用△G表示。 8。△G值用于生物化学能量学是假设每个反应物和产物都能等解离他门南的标准 状态是未解离形式和解离形式的混和状态,两种状春的存在正是p旺-7.0的环境。因此 △G是以pH-7.0为基的。如果p正不等于7.0,就不能用△G值因为一种组分或 种以上的组分的解离程度都可能改变p过值。p旺值的变化可导致反应中对甘+和O离子 结合的差异或春放的差异。 4,生化系统的标推自由能变化在过去以卡或千卡表示。生化国际委员会建议今后用焦 耳(Joml)或干焦耳摩尔表示(ilojou1a/mol)。1卡相当于4,184焦耳,简称焦),1干 卡相当于4,84千焦耳(k或千熊)。 第四节高能磷酸化合物 一、高能确酸化合物的概念 磷酸化合物在生物机体的换能过程中占有重要地位。机体内有许多磷酸化合物,其磷酸基 ·1

团水解时可释放出大量的自由能,这类化合物称为高能磷酸化合物。腺三磷(P)就是这类 化合物的典型代表。 腺=磷“~”代裘水解时产生篇能的赞 腺三磷结构中的两个磷酸基团(B.Y)可从y端依次移去而生成腺二磷(ADP)和腺一磷 (AMP)。ATP在细胞的产能和需能过程中起着重要的桥梁作用,机体在物贡氧化的某些过程 释放出的大量自由能往往先形成高能磷酸化合物ATP,再由ATP水解为ADP和无机磷酸 而释放出大量自由能供给需能反应。ATP磷酸酐键水解时,释放出7300卡/摩尔能囊(0. 千焦/摩尔),一般将水解时释放5000卡(20.92千焦)以上自由能的化合物称为高能化合物。 高能化合物与低能化合物是相对而言的。化学家认为健能是断裂一个键所需妥的能量,而生物 化学家所说的高能化合物,是指水解该能时反应的△G',而不是指断裂该键所蒂要的能量, 二、高能磷酸化合物的类型 机体内高能化合物的种类是很多的,不只是高能磷酸化合物,根据其型的特点,可将高 能化合物分为以下几种类型, 1.磷氧键型(-O一P)属于这种健型的化合物很多,又可分成几类。 ()酰基群酸化合物例如: 0 800 00 CH, A- 3-磷酸甘油酸磷酸 乙酰一酸 (3-phosphog phosphate) -0-0腺苷 0- 'NH 0 酰基腺苷酸 氨酰腺苷酸 (aeyl acenylato) (aminoaeyl adonylate) ·18
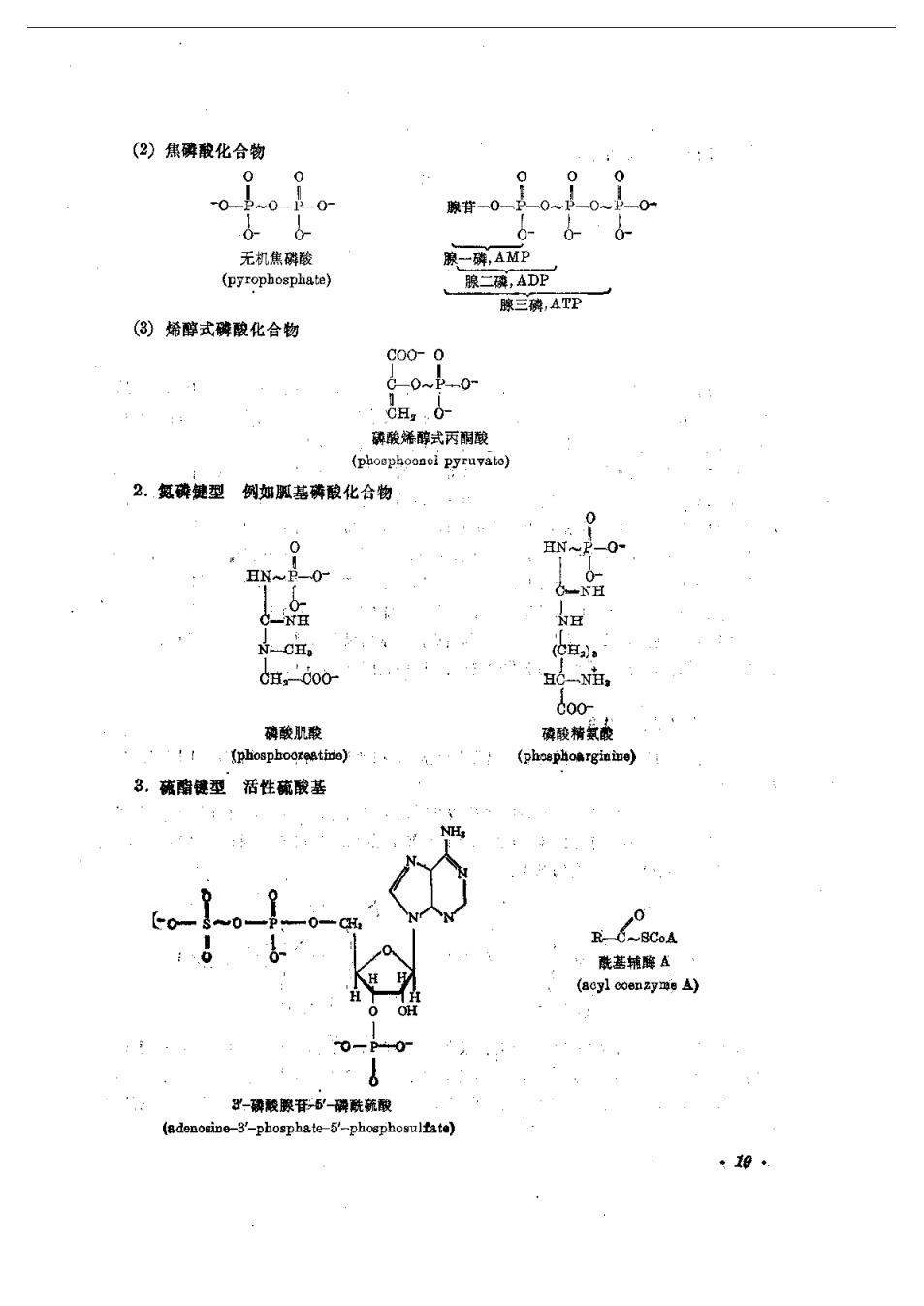
(2)焦磷酸化合物 0 腺苷-0 无机焦磁酸 象-磷,AMP (Pyrophoaphate)】 腺二,ADP 膜三魂,ATP (③)烯醇式磷酸化合物 cH.0 酸烯醇式丙 2。氨弹健型例如压基磷酸化合物 C00 磷酸肌酸 璃酸蒂氨酸 (phosphooreetine) (phoephoarginine) 3,防酯健型活性硫酸基 -phosphate-5'-phosphosultata)