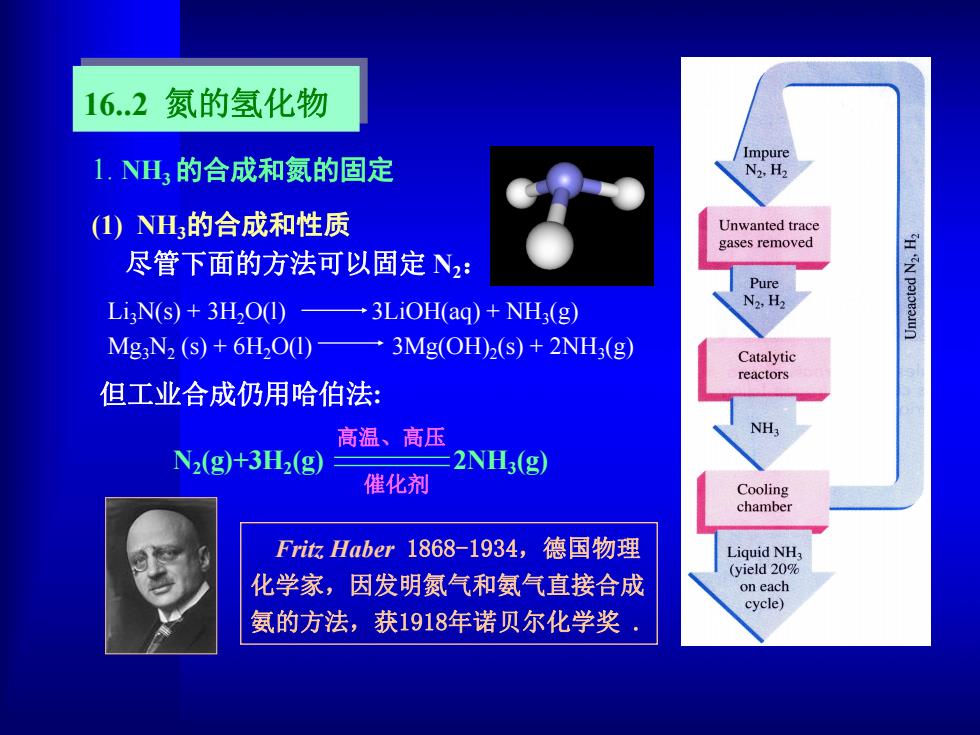
16.2 氮的氢化物 Impure 1.NH的合成和氮的固定 N2,H2 (1)NH3的合成和性质 Unwanted trace gases removed 尽管下面的方法可以固定N2: Pure LigN(s)+3H2O(1) →3LiOH(aq)+NH(g) N2,H2 Mg:N2 (s)+6H2O(1)3Mg(OH)2(s)+2NH3(g) Catalytic reactors 但工业合成仍用哈伯法: 高温、高压 NH3 N2(g+3H2(g》 2NH;(g) 催化剂 Cooling chamber Fit欣Haber1868-1934,德国物理 Liquid NH (yield 20% 化学家,因发明氮气和氨气直接合成 on each cycle) 氨的方法,获1918年诺贝尔化学奖·
16.2 氮的氢化物 (1) NH3的合成和性质 尽管下面的方法可以固定 N2: Li3N(s) + 3H2O(l) 3LiOH(aq) + NH3(g) Mg3N2 (s) + 6H2O(l) 3Mg(OH)2(s) + 2NH3(g) Fritz Haber 1868-1934,德国物理 化学家,因发明氮气和氨气直接合成 氨的方法,获1918年诺贝尔化学奖 . 1. NH3的合成和氮的固定 但工业合成仍用哈伯法: N2(g)+3H2(g) 2NH3(g) 高温、高压 催化剂
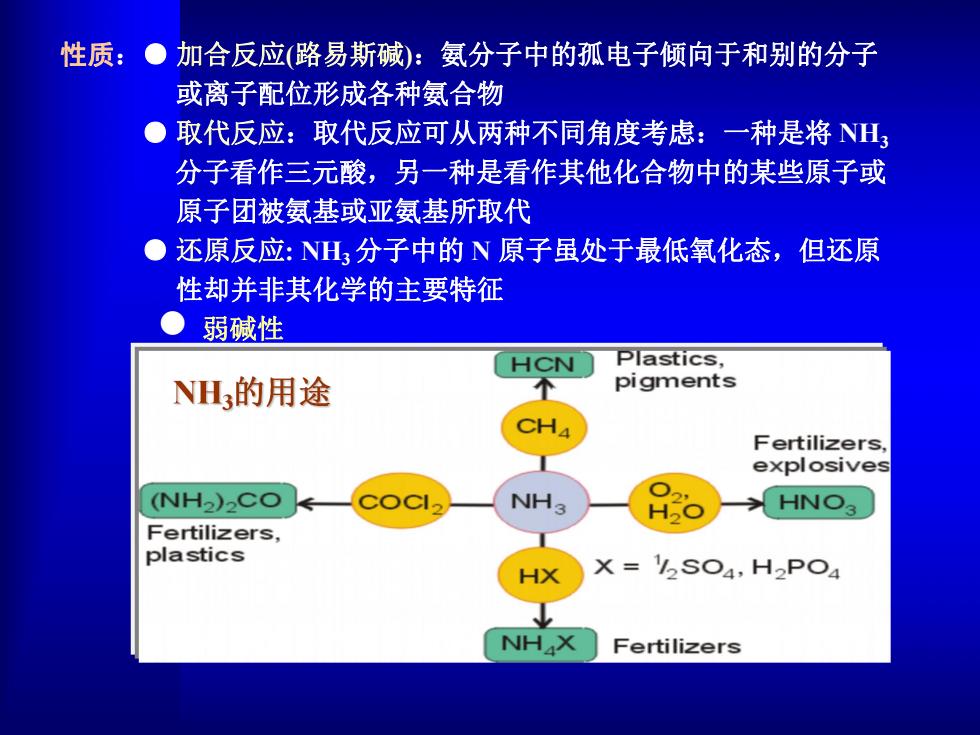
性质:●加合反应(路易斯碱):氨分子中的孤电子倾向于和别的分子 或离子配位形成各种氨合物 取代反应:取代反应可从两种不同角度考虑:一种是将NH 分子看作三元酸,另一种是看作其他化合物中的某些原子或 原子团被氨基或亚氨基所取代 ●还原反应:NHⅢ3分子中的N原子虽处于最低氧化态,但还原 性却并非其化学的主要特征 弱碱性 HCN Plastics, NH3的用途 pigments Fertilizers, explosives (NH2)CO NH3 HNO3 Fertilizers, plastics SO4,H2PO4 NHX Fertilizers
性质:● 加合反应(路易斯碱):氨分子中的孤电子倾向于和别的分子 或离子配位形成各种氨合物 ● 取代反应:取代反应可从两种不同角度考虑:一种是将 NH3 分子看作三元酸,另一种是看作其他化合物中的某些原子或 原子团被氨基或亚氨基所取代 ● 还原反应: NH3分子中的 N 原子虽处于最低氧化态,但还原 性却并非其化学的主要特征 l 弱碱性

(2)生产尿素的反应和工艺流程 尿素是最重要的含氮肥料,也是当今世界上最大的含氮化 合物.工业上生产尿素以NH3和CO2为原料: CO2(g+2NH3①=NH,COONH①4,Hm=-117 kJ.mol-1 NH,COONH4①=H,NCONH,①+H2OI △,Hm=15.5kJmo1 现代化流程实行CO2和NH3的全循环,收率可达98.6%-99.5%. high-pressure low-pressure condensation column condensation column H20 stock solution low-pressure reaction decomposition column column urea solution thin-film evaporator
(2) 生产尿素的反应和工艺流程 尿素是最重要的含氮肥料,也是当今世界上最大的含氮化 合物 . 工业上生产尿素以 NH3 和 CO2为原料: CO2(g) + 2 NH3(l) = NH2COONH4(l) rHm = -117 kJ·mol -1 NH2COONH4(l) = H2NCONH2(l) + H2O(l) rHm = 15.5 kJ·mol -1 现代化流程实行CO2 和 NH3 的全循环,收率可达 98.6% – 99.5%

2.铵盐 铵盐易于热分解,实质是质子的转移。分解产物和阴离子 对应的酸的氧化性、挥发性以及分解温度有关,呈现以下规律: ●若对应的酸有挥发性而物氧化性,则分解产物为NH和相应的 酸,如NHCI、NH HCO3 ●若酸是不挥发性的,则只有NH3挥发逸出,而酸或酸式盐则残 留在容器中,如NH4)2SO4(NH4)PO4 ●若对应的酸有氧化性,则分解出来的NH3立即被氧化成氮或氮 的氧化物,并放出大量的热,如NH4NO3 NH,NO3△→NO(g)+2H2O(g) NH,N0m→V2(g)+2O,(8)+2H,0g)
2. 铵盐 铵盐易于热分解,实质是质子的转移。分解产物和阴离子 对应的酸的氧化性、挥发性以及分解温度有关,呈现以下规律: l若对应的酸有挥发性而物氧化性,则分解产物为NH3和相应的 酸,如NH4Cl、NH4HCO3; l若酸是不挥发性的,则只有NH3挥发逸出,而酸或酸式盐则残 留在容器中,如(NH4)2SO4、(NH4)3PO4; l若对应的酸有氧化性,则分解出来的NH3立即被氧化成氮或氮 的氧化物,并放出大量的热,如NH4NO3 . ( ) 2 ( ) 2 1 ( ) ( ) 2 ( ) 2 2 2 573 4 3 4 3 2 2 NH NO N g O g H O g NH NO N O g H O g K

3.肼(hydrazine)4.羟氨(Oxyammonia)5.叠氨化物(Azide) 它们的氧化值分别为-2,-1和-13 ● 结构: HN N2Hi NH2OH 制备 2 NaOH+Cl2 二 NaOCl NaCl H,O NaOCl+NH,NH,Cl NaOH N2H4+) NH2CI NaOH NH;N2H4 NaCl +H2O 2 NaOH Cl2 2 NH3 3N2H +2 NaCl +2 HO NH2OH NOz (ag)+2 HSO;(aq)N(OH(SO)(a)+OH-(aq) N(OH)(SO3)22-(aq)+H3O*(aq)+H2O(I)50C H3NOH*(aq)+2 HSO(aq) HN3 NH2NH2 HNO22 H2O+HN3 都是路易斯碱,碱性依NH3,N,H4,NHOH的顺序下降
3. 肼(hydrazine) 4.羟氨(Oxyammonia) 5.叠氮化物(Azide) 它们的氧化值分别为-2,-1和-1/3 ● 结构: N2H4 NH2OH ● 制备 ● 都是路易斯碱,碱性依 NH3,N2H4,NHOH 的顺序下降. N2H4 NH2OH HN3 2 NaOH + Cl2 NaOCl + NaCl + H2O NaOCl + NH3 NH2Cl + NaOH NH2Cl + NaOH + NH3 N2H4 + NaCl + H2O 2 NaOH + Cl2 + 2 NH3 N2H4 + 2 NaCl + 2 H2O +) NO2 -(aq) + 2 HSO3 -(aq) N(OH)(SO3)2 2-(aq) + OH-(aq) N(OH)(SO3)2 2-(aq) + H3O+(aq) + H2O(l) H3NOH+(aq) + 2 HSO4 -(aq) 0℃ 50℃ NH2NH2 + HNO2 2 H2O + HN3 N N N H HN3