
§4.1.4酸碱反应的平衡常数 一解离常数 从不同的视角研究酸碱平衡,给出 的酸碱定义也不同。目前,得到认可的 定义约有十余种。例如,电离理论,溶 剂理论,质子理论和电子理论等,每种 理论都各有优缺点和适用范围。 1.酸碱电离理论 ■酸(acid): 能解离出H+的物质。 ■碱(base):能解离出OH-的物质
§ 4.1.4 酸碱反应的平衡常数 ——解离常数 从不同的视角研究酸碱平衡,给出 的酸碱定义也不同。目前,得到认可的 定义约有十余种。例如,电离理论,溶 剂理论,质子理论和电子理论等,每种 理论都各有优缺点和适用范围。 1. 酸碱电离理论 酸(acid):能解离出H+的物质。 碱(base):能解离出OH-的物质

2.酸碱质子理论(BrΦstead酸碱理论) (Brstead theory of acid-base) ■酸(acid):溶液中凡能给出质子的物质。 ■碱(base):溶液中凡能接受质子的物质。 ■ 在分析化学中广泛采用的是布朗斯台德 ( BrΦstead) 的酸碱质子理论,这是因为该 理论对酸碱强弱的量化程度最高,便于定量 计算,它的缺点是不适合于无质子存在的酸 B+H2O-B+H2o+K.-[0] 碱体系。 [HB ■酸 共轭碱水合氢离于 acid conjugate base hydronium ion
2. 酸碱质子理论(BrΦstead酸碱理论) (BrΦstead theory of acid-base) 酸(acid):溶液中凡能给出质子的物质。 碱(base):溶液中凡能接受质子的物质。 在分析化学中广泛采用的是布朗斯台德( BrΦstead)的酸碱质子理论,这是因为该 理论对酸碱强弱的量化程度最高,便于定量 计算,它的缺点是不适合于无质子存在的酸 碱体系。 HB + H2O B- + H3O+ 酸 共轭碱 水合氢离子 acid conjugate base hydronium ion ][ ][][ 3 HB OHB Ka − + ⋅ =

酸碱反应的实质 共轭酸碱对(Conjugate acid-base pairs) 酸碱半反应:酸给出质子和碱接受质子的反应 √醋酸(Acetic acid)在水中的离 解: 半反 HAc(酸1)三Ac(碱1)+HH 半反应2 Ht+H,O(碱2)亡H,O+(酸2) HAc(酸1)+H,0(碱2)三H,0+(酸2)+Ac(碱1) 共轭酸碱对(Conjugate pais)
酸碱反应的实质 共轭酸碱对 (Conjugate acid-base pairs) 酸碱半反应: 酸给出质子和碱接受质子的反应 9 醋 酸 (Acetic acid) 在水中的离 解: 半反应1 HAc(酸1) Ac - (碱1) + H + 半反应2 H+ + H 2 O(碱2) H 3 O +(酸2) HAc(酸1) + H 2O (碱2) H 3 O +(酸2) + Ac - (碱1) 共轭酸碱对(Conjugate pais)

氨在水中的离解: (Dissociation of amine in water) 半反应1 NH3(碱1)+Ht三】 NH4+(酸1) 半反应2 H,0(酸2)三OH(碱2)+H NH3(碱1)+H2O (酸2)OⅢ(碱2)+NH+(酸1) 共轭酸碱对
半反应1 NH3(碱1)+ H+ NH4+(酸1) 半反应2 H2O(酸2) OH-(碱2)+ H+ NH3(碱1) + H2O (酸2) OH- (碱2) + NH4+ (酸1) 共轭酸碱对 氨在水中的离解: (Dissociation of amine in water)
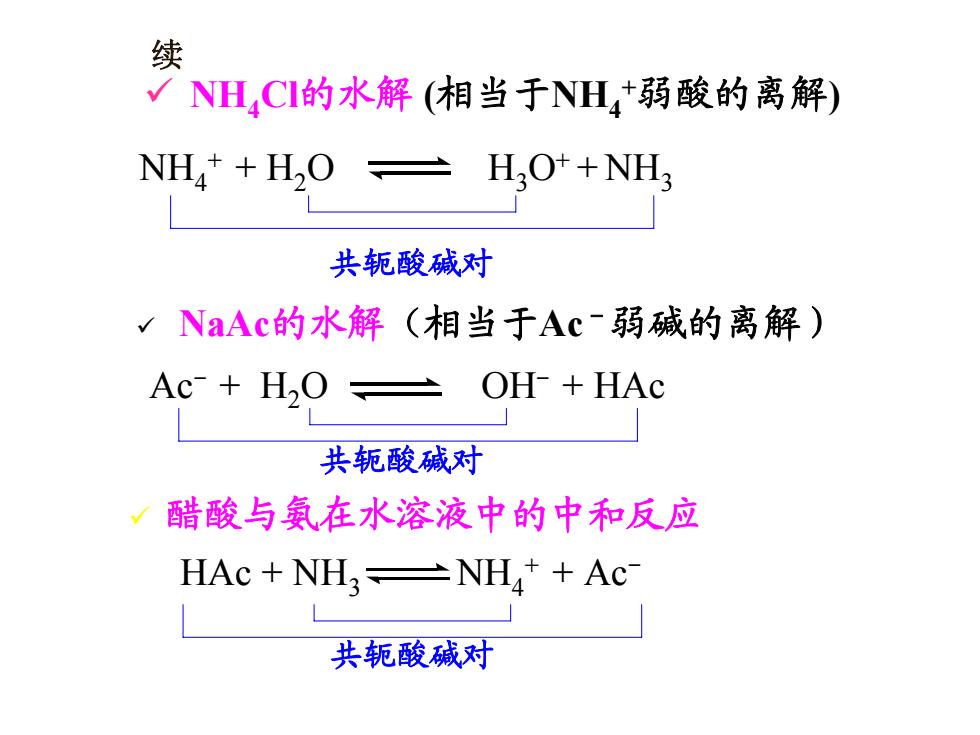
续 √NH,CI的水解(相当于NH+弱酸的离解) NH*+H2O H2O++NH2 共轭酸碱对 √NaAc的水解(相当于Ac~弱碱的离解) Ac-+H,O OH HAc 共轭酸碱对 √醋酸与氨在水溶液中的中和反应 HAC NHNH++Ac- 共轭酸碱对
续 9 NH4Cl的水解 (相当于NH4+弱酸的离解) 9 NaAc的水解(相当于Ac-弱碱的离解) NH4+ + H2O H3O+ + NH3 Ac- + H2O OH- + HAc 共轭酸碱对 共轭酸碱对 9 醋酸与氨在水溶液中的中和反应 HAc + NH3 NH4+ + Ac- 共轭酸碱对