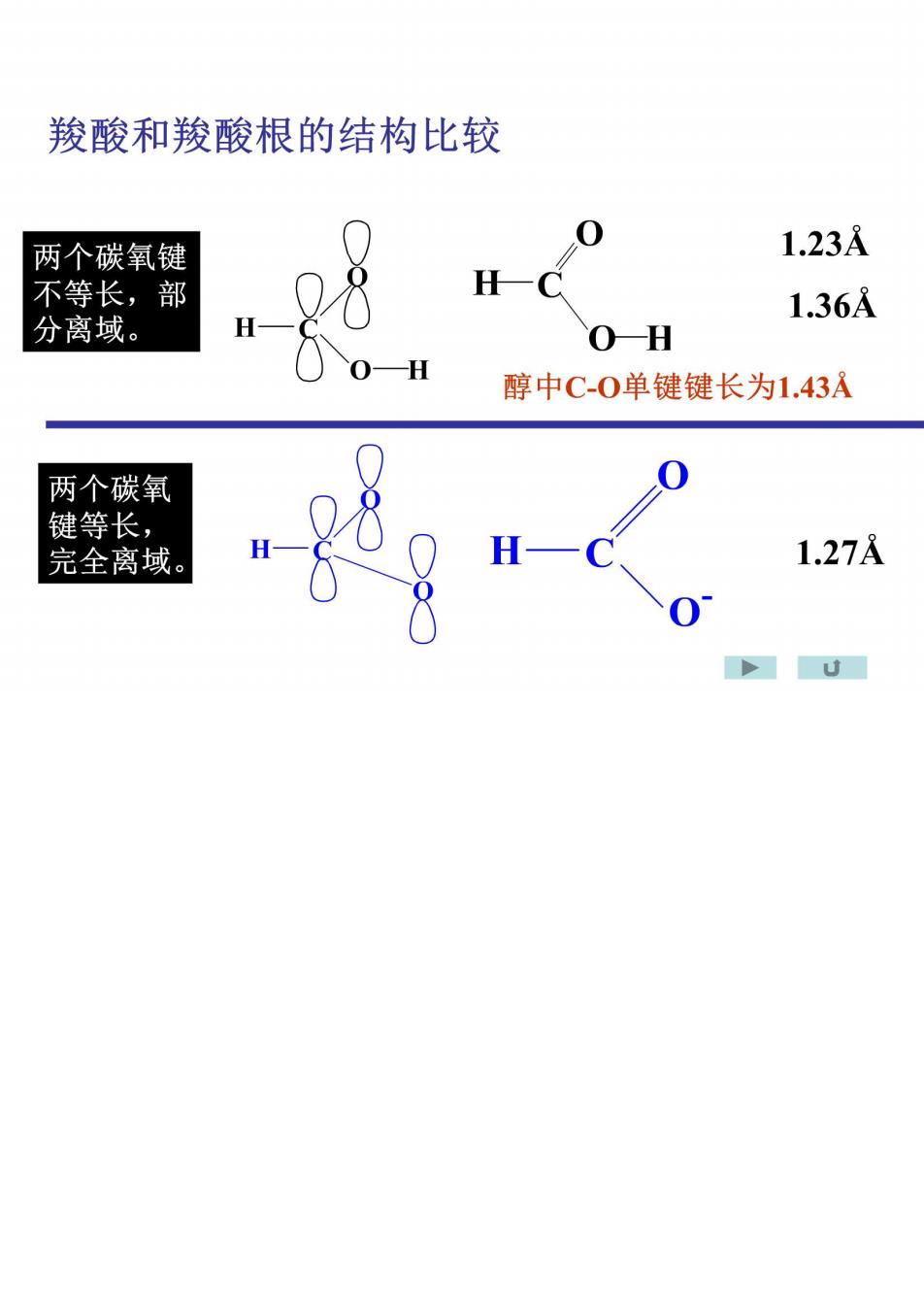
羧酸和羧酸根的结构比较 两个碳氧键 1.23A 不等长,部 1.36A 分离域。 0-H 醇中C-0单键键长为1.43A 两个碳氧 键等长, 完全离域。 1.27A
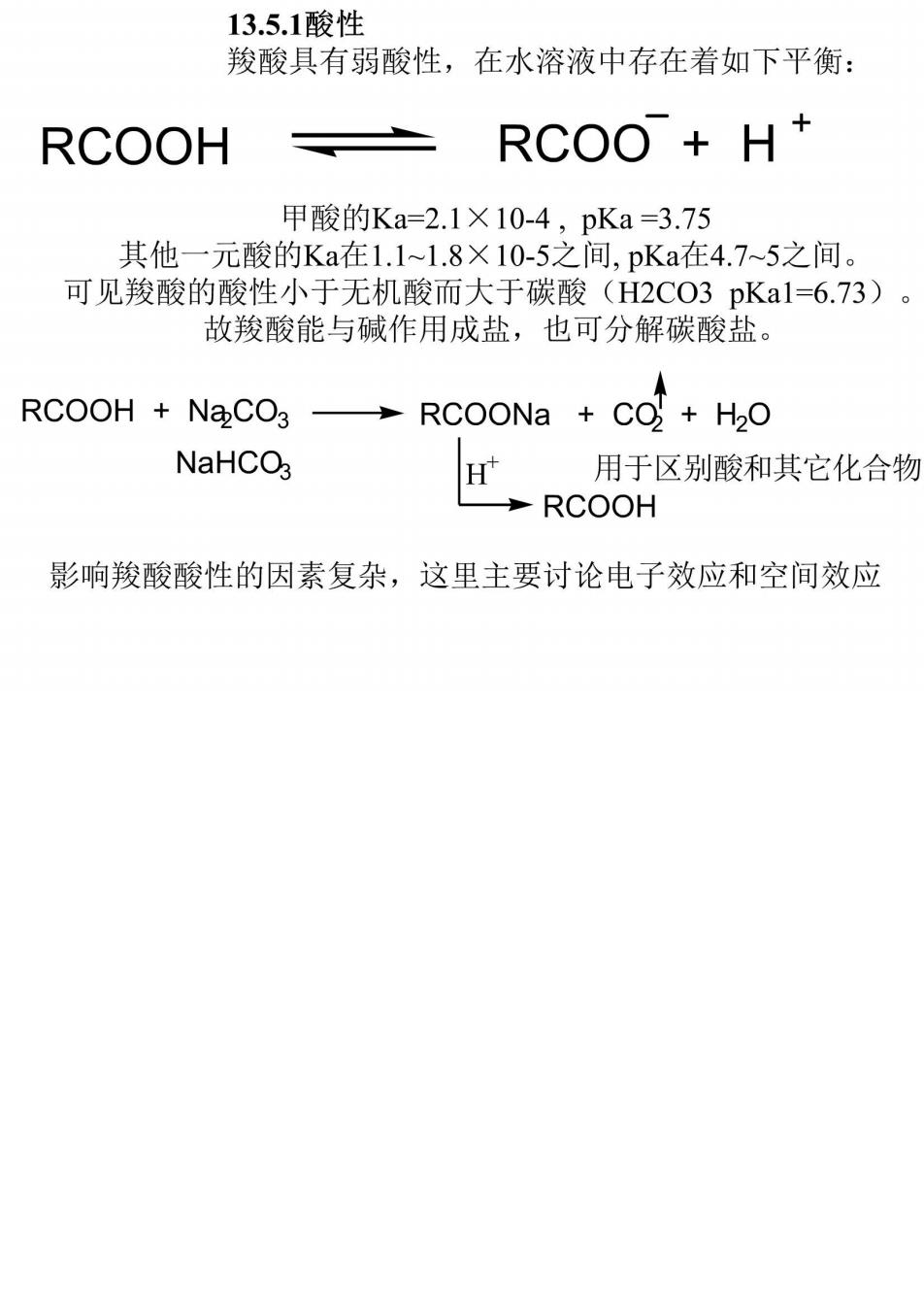
13.5.1酸性 羧酸具有弱酸性,在水溶液中存在着如下平衡: RCOOH 上 RCOO +H+ 甲酸的Ka=2.1×10-4,pKa=3.75 其他一元酸的Ka在1.1~1.8×10-5之间,pKa在4.7~5之间。 可见羧酸的酸性小于无机酸而大于碳酸(H2CO3pKal=6.73)。 故羧酸能与碱作用成盐,也可分解碳酸盐。 RCOOH NaCO3 RCOONa CO+H2O NaHCO 矿用于区别酸和其它化合物 RCOOH 影响羧酸酸性的因素复杂,这里主要讨论电子效应和空间效应

OH 无机酸>RCOOH>H2CO3> >H20 ROH 1-2 4-5 6.4(pka1) 9-10 15.7 16-19 为什么RCOOHE的酸性比ROH的酸性大? 羧酸酸性的强弱取决于电离后所形成的羧酸根负离子(即共轭 碱)的相对稳定性。 HCOOH CH:COOH CICH2COOH CH3CH2COOH CH5COOH 3.77 4.74 2.86 4.88 4.20 13.5.2诱导效应、共轭效应对酸性的影响 1.诱导效应的影响 G-CH2COO° G←CH2COO GCH2COO

氯代酸的生成 Br RCH >COOH Br 2 RCHCOOH P△ Br 2 R-C.COOH Br P△ Br 磷的作用是生成卤代磷。卤代磷的催化剂作用是让羧酸生成酰卤。 2P+3B2+2PB5 RCH2COOH PBr3 RCH2COBr OH Br Br OH RCH2COBr RCH=C-Br+Br' RCH--Br+Br ‖- RCH-C-Br HB Br
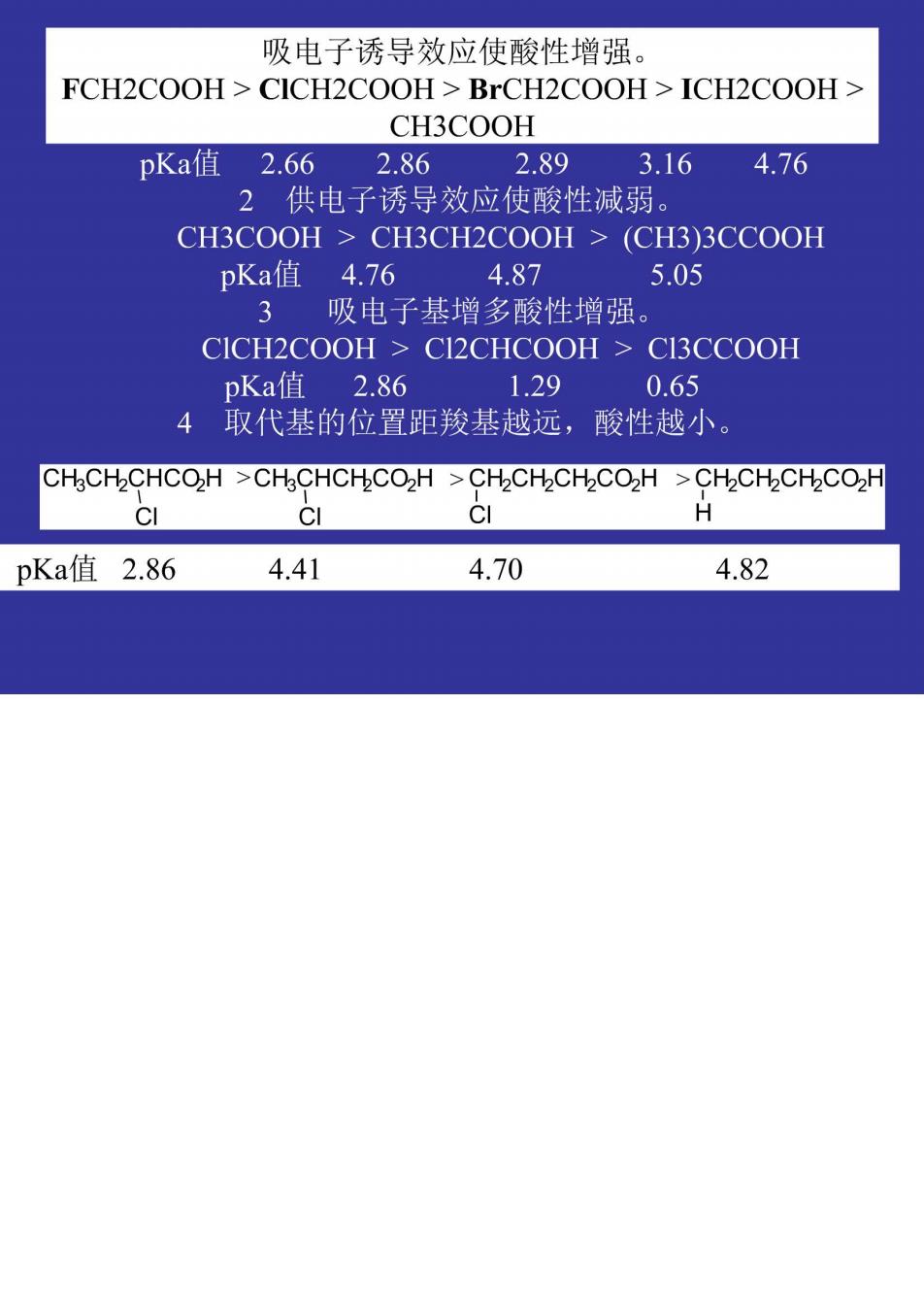
吸电子诱导效应使酸性增强。 FCH2COOH CICH2COOH BrCH2COOH ICH2COOH CH3COOH pKa值2.66 2.86 2.89 3.16 4.76 2供电子诱导效应使酸性减弱。 CH3COOH CH3CH2COOH >(CH3)3CCOOH pKa值4.76 4.87 5.05 3 吸电子基增多酸性增强。 CICH2COOH CI2CHCOOH CI3CCOOH pKa值2.86 1.29 0.65 取代基的位置距羧基越远,酸性越小 CHCH2CHCOH >CHCHCHCO2H >CH2CH2CH2CO2H >CH2CH2CH2COH CI c 9 H pKa值2.86 4.41 4.70 4.82