
对一般反应 aA+bBdD+eE 其反应的化学反应速率可用任意 一反应物或产物单位时间内浓度的 变化来表示,平均反应速率为 1△CA 1 ACB 1 ACp 1 ACE a△t b△td△t e△t
对一般反应 aA + bB dD + eE 其反应的化学反应速率可用任意 一反应物或产物单位时间内浓度的 变化来表示,平均反应速率为 t C t e C t d C t b C a A B D E = = = − = − 1 1 1 1

二、反应速率理论 1.有效碰撞理论 其要点归结如下: (1)要发生化学反应,反应物分子 必须碰撞 (2)在化学反应中,只有一定数目 的少数分子在碰撞时才能发生反应
二、反应速率理论 1. 有效碰撞理论 其要点归结如下: (1)要发生化学反应,反应物分子 必须碰撞 (2)在化学反应中,只有一定数目 的少数分子在碰撞时才能发生反应

■根据有效碰撞理论,只有具有较高能量 的活化分子间的碰撞才能发生反应 能够发生反应的碰撞,称为有效碰撞; 不能够发生反应的碰撞,叫弹性碰撞
根据有效碰撞理论,只有具有较高能量 的活化分子间的碰撞才能发生反应 能够发生反应的碰撞,称为有效碰撞; 不能够发生反应的碰撞,叫弹性碰撞
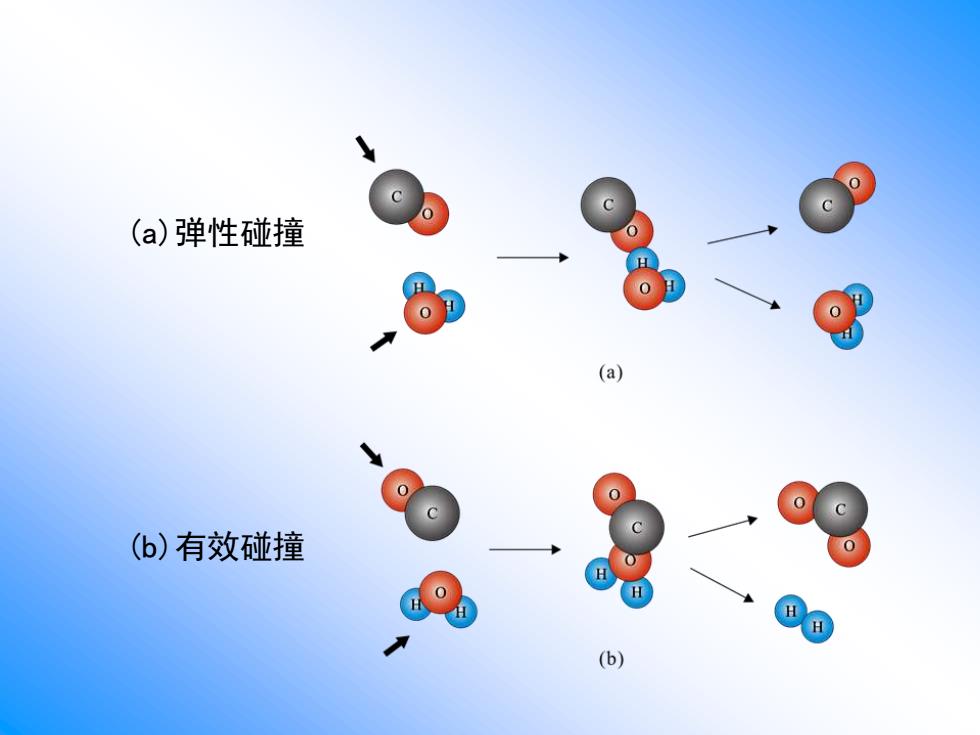
(a)弹性碰撞 (a) c (b)有效碰撞 H (b)
(a)弹性碰撞 (b)有效碰撞

活化分子、活化能 能够发生有效碰撞的分子,叫活化分子 活化分子具有的平均能量与反应物分子 具有的平均能量的差值,叫活化能。符 号为“Ea” 口通常活化分子占的百分数是很小的
活化分子、活化能 能够发生有效碰撞的分子,叫活化分子 活化分子具有的平均能量与反应物分子 具有的平均能量的差值,叫活化能。符 号为“Ea” 通常活化分子占的百分数是很小的