
3.弱碱的解离常数K, 同样,一元弱碱B溶液中存在着B 和H,0之间的质子传递反应。 B+H2O=HB++OH- K,=[HB]IOH】 [B] Kb·碱的解离常数 K的大小,表示了碱的强弱
3.弱碱的解离常数Kb 同样,一元弱碱B溶液中存在着B 和H2O之间的质子传递反应。 B+H2O=HB++OH- Kb-碱的解离常数 Kb的大小,表示了碱的强弱 [ ] [ ][ ] B HB OH Kb + − =
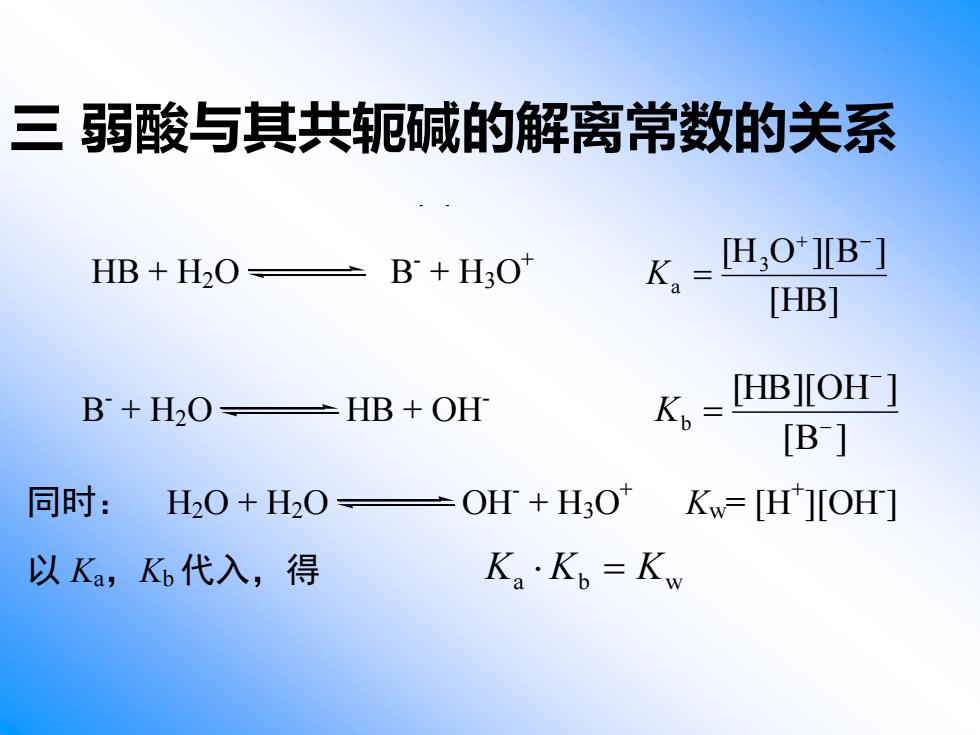
三弱酸与其共轭碱的解离常数的关系 HB+H2O± B+H3O" K,=L,0[B】 [HB] B+H2O-HB+OH K。=HB]IOH] [B] 同时:H20+H20= OH +H3O KW=HJOH] 以Ka,K代入,得 Ka·Kb=Kw
三 弱酸与其共轭碱的解离常数的关系 HB + H2O B- + H3O + [HB] [H O ][B ] 3 a + − K = B - + H2O HB + OH- [B ] [HB][OH ] b − − K = 同时: H2O + H2O OH- + H3O + Kw= [H+ ][OH- ] 以 Ka,Kb 代入,得 Ka Kb = Kw

Ka·Kb=Kw 只要知道共轭酸碱对中弱酸的Ka 或弱碱的K,就可以利用上式求出 其共轭碱的K或共轭酸的Ka。 Kp=K/K Ko=Kv/Kp
只要知道共轭酸碱对中弱酸的Ka 或弱碱的Kb,就可以利用上式求出 其共轭碱的Kb或共轭酸的Ka。 Ka Kb = Kw Ka Kw Kb = / Kb Kw Ka = /

例:已知HCN的Ka=5.0X10-10mol/L, 则CN-的碱常数Kb为 (A)5.0×10-14 (B)5.0×10-10 (C) 2.0×10-6 Kb=Kv/Ko (D)2.0X10-5 1014 (E)2.0×10-4 5.0×1010
例:已知HCN的Ka = 5.0×10-10 mol/L, 则CN-的碱常数Kb为 (A)5.0×10-14 (B)5.0×10-10 (C) 2.0×10-6 (D)2.0×10-5 (E)2.0×10-4 10 14 5.0 10 10 / − − = Kb = Kw Ka

第三节酸碱溶液pH值的计算 (一)水溶液的酸碱性及pH值 在纯水、酸溶液或碱溶液中,H+和 OH总是存在的,并且有 H][OH]=Kw=10-14 它反映了水溶液中H+和OH~浓度 之间的数量关系
第三节 酸碱溶液pH值的计算 (一)水溶液的酸碱性及pH值 在纯水、酸溶液或碱溶液中,H+和 OH-总是存在的,并且有 [H+ ][OH- ]=Kw =10-14 它反映了水溶液中H+和OH-浓度 之间的数量关系