
def dE1dn2、反应速率的定义T一dtVB dt对于任意反应aA + bB→gG + hHdn1dn1 dnG _ 1 dnHT=dtbdtgdthdta注意:(1)与选择物质B无关:(2))对何种条件下进行的反应都是严格的、正确的,(3)恒容条件下的速率表达形式r=J/V:
11 dt dn dt d J B B def 1 dt dn dt h dn dt g dn dt b dn a J A B G H 1 1 1 1

3.单位体积的反应速率rl mol·dmt3.s-lmol·L-l.s-1ordedn1dBdcB1VdtVdtVVBdtdt例如对于气相反应:在定温定容条件下2NO + Br2→2NOBr1 d[NO]d[Br,]1 d[NOBr=2dtdt2dt
12 Vdt dn Vdt d V J r B B 1 dt d B dt dc B B B 1 1 [ ] dt d NOBr dt d Br dt d NO r [ ] 2 [ ] [ ] 1 2 1 2
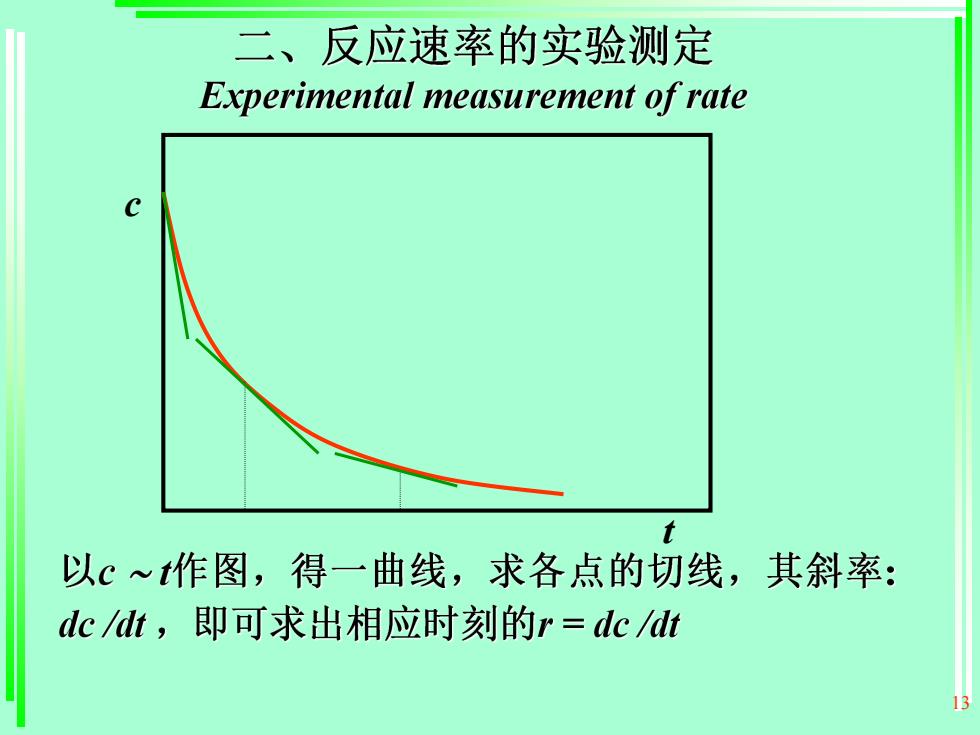
二、反应速率的实验测定Experimental measurementof rate以c~t作图,得一曲线,求各点的切线,其斜率:dc/dt,即可求出相应时刻的r=dc/dt
13 c t

浓度测定方法分为1.化学法,2.物理法1、化学法:化学分析法测浓度关键是“冻结反应”,方法有:骤冷、冲稀、加阻化剂或脱离催化剂等。其优点是设备简单,测量直接:缺点是很难找到合适的“冻结方法”2、物理法:测量某种物理性质,条件是该性质与浓度有单值函数关系。压力,旋光度、折光率、电导、比色、光谱等物理性质均可应用,其优点是间接测量,不干扰反应,方便,迅速,可连续测定
14

三、反应速率的经验表达式:1dcB积分式:CB=f(t)微分式: r=f(cB)=dt2虽有相同的化学反应计量方程式,由于反应机理不同,反应速率方程不同:r = k[H,][I,]H+I →2HIk[H, ][Br,]1/2H2+Br2→2HBr1+k[HBr]/[Br]H,+ Cl2 →2HCIr = k[H,I[C,]/
15 dt dc r f c B B B 1 ( ) [ ][ ] 2 2 r k H I 1 [ ]/[ ] [ ][ ] 2 ' 1/ 2 2 2 k HBr Br k H Br r 1/ 2 2 2 r k[H ][Cl ]