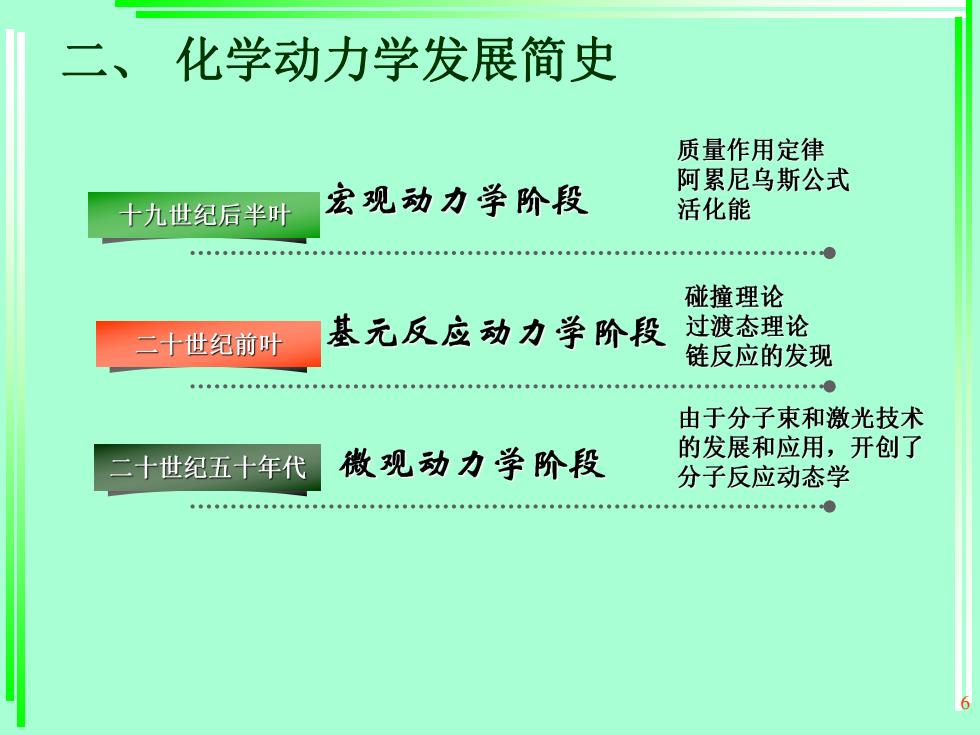
化学动力学发展简史质量作用定律阿累尼乌斯公式宏观动力学阶段活化能十九世纪后半叶碰撞理论过渡态理论基元反应动力学阶段二十世纪前叶链反应的发现由于分子束和激光技术的发展和应用,开创了微观动力学阶段二十世纪五十年代分子反应动态学
6 二、 化学动力学发展简史

三、反应机理Mechanism of reaction反应机理:反应实际进行与经历的具体步骤例如“总反应”:H(g)+ Cl(g)→2HCI (g)实际上反应进行了下列步骤:i. Cl, →>2CIii. CI·+H, →HCI+H·ii. H+ Cl, →HCI + CI.iv. 2CI+M→CI, +M(M为其它气体或器壁,起传递能量作用,必须存在)
7

微观概念“基元反应”:反应物分子经直接作用生成新产物的过程“基元化学物理步骤”:如分子碰撞发生能量转移等“反应分子数”:基元反应中,直接作用所必需的反应物微观粒子数。分为:单分子反应,双分子反应,三分子反应。(见上页)“反应机理”或“反应历程”:组成宏观总反应的基元反应的总合及其序列。“简单反应”:仅由一种基元反应组成的总反应。“复合反应”:由2种或2种以上基元反应组成的总反宏观概态应
8

89.2反应速率公式Theformula of'thereaction rate一、反应速率的表示法二、反应速率的实验测定三、反应速率的经验表达式:微分式;积分式四、反应级数五、质量作用定律六、速率常数
9

反应速率的表示方法The representation of reaction rate反应进度1、反应+ bB+ hHaA→gG1-0-0nA,0nG,0nB,0NH,0t=tnBnGNHnAdefdefdnBnBAnBnB,0ds8ormol福VVBBB7
10 mol n n n B B B B B def / ,0 B B def dn or d