
第一章 有机化合物的结构特点与研究方法 7.如图是一个核磁共振氢谱,请你观察图谱,分析其可能是 A.甲醇(CHOH) B.甲烷 下列物质中的( )。 C.丙烷 D.乙烯 答案B 9.验证某有机化合物属于烃,应完成的实验内容是( )。 A.只需验证该有机化合物是否易燃烧 B.只要证明它完全燃烧后的产物只有H,O和CO2 C.只测定其燃烧产物中H2O和CO2的物质的量之比 987654321 D.只测定该试样的质量及试样完全燃烧后生成CO2和 H2O的质量 A.CH,CH2CH2CHa 答案D B.(CH,)2CHCH 10.下列有机化合物分子的核磁共振氢谱图,能给出三组峰 C.CHCH,CH,OH 的是( )。 D.CH,CH,COOH A.CHCH,CH 答案C B.CH,-O-CH 8.质谱法能够对有机分子进行结构分析,其方法是让极少量 的(103g)化合物通过质谱仪的离子化室,样品分子大量 C.CH- -CH,CH 离子化,少量分子碎裂成更小的离子。如C2H。离子化可 得到C2H、,C2H甘、C2H…然后测定其质荷比。设H 的质荷比为3,某有机物样品的质荷比如图所示(假设离 D.CH-C-O-CH 子均带一个单位正电荷,信号强度与该离子的多少有关), 答案C 则该有机化合物可能是( 11.现代化学中,常用来鉴定元素的方法是()。 A.红外光谱分析 B.X射线衍射 C.质谱分析 D.光谱分析 答案D 2 121416 质荷比 课堂·重难突破 有机化合物的分离、提纯 续表 分离、提纯 重难归纳 目的 主要仪器 实例 的方法 1.有机化合物分离、提纯的常用方法。 分离、提纯固体混 重结晶 烧杯、 提纯苯甲酸 分离、提纯 合物 过滤器 目的 主要仪器 实例 的方法 除去胶体中的小分 半透膜、 除去淀粉中的 分离、提纯互不相溶 分离硝基苯 渗析 萃取 分液漏斗 子、离子 烧杯 氯化钠、葡萄糖 的液体混合物 与水 2.常用分离和提纯方法的注意事项。 蒸馏烧瓶 分离、提纯沸点相差 分离乙醛与 蒸馏 冷凝管、 分离、 较大的混合溶液 接收器 乙醇 提纯方法 适用范围 注意事项 各物质的沸点相差较大,一般在 分离、提纯气体混 除去甲烷中的 洗气 洗气装置 30℃以上,热稳定性较好,冷却水 合物 乙烯 蒸馏 互溶的液体 是下口进、上口出,加入沸石(碎瓷 片)可以防止暴沸,温度计水银球 位于蒸馏烧瓶支管口处 21
第一章 有机化合物的结构特点与研究方法 7.如图是一个核磁共振氢谱,请你观察图谱,分析其可能是 下列物质中的( )。 d 9 8 7 6 5 4 3 2 1 0 ! " # $ A.CH3CH2CH2CH3 B.(CH3)2CHCH3 C.CH3CH2CH2OH D.CH3CH2COOH 答案 C 8.质谱法能够对有机分子进行结构分析,其方法是让极少量 的(10-3g)化合物通过质谱仪的离子化室,样品分子大量 离子化,少量分子碎裂成更小的离子。如C2H6 离子化可 得到C2H+ 6 、C2H+ 5 、C2H+ 4 ……然后测定其质荷比。设 H+ 的质荷比为β,某有机物样品的质荷比如图所示(假设离 子均带一个单位正电荷,信号强度与该离子的多少有关), 则该有机化合物可能是( )。 15 2 12 14 16 ! " # $ %&'(b) A.甲醇(CH3OH) B.甲烷 C.丙烷 D.乙烯 答案 B 9.验证某有机化合物属于烃,应完成的实验内容是( )。 A.只需验证该有机化合物是否易燃烧 B.只要证明它完全燃烧后的产物只有 H2O和CO2 C.只测定其燃烧产物中 H2O和CO2 的物质的量之比 D.只测定该试样的质量及试样完全燃烧后生成 CO2 和 H2O的质量 答案 D 10.下列有机化合物分子的核磁共振氢谱图,能给出三组峰 的是( )。 A.CH3CH2CH3 B.CH3—O—CH3 C.CH3 C O CH2CH3 D.CH3 C O O CH3 答案 C 11.现代化学中,常用来鉴定元素的方法是( )。 A.红外光谱分析 B.X射线衍射 C.质谱分析 D.光谱分析 答案 D 课堂·重难突破 一 有机化合物的分离、提纯 重难归纳 1.有机化合物分离、提纯的常用方法。 分离、提纯 的方法 目的 主要仪器 实例 萃取 分离、提纯互不相溶 的液体混合物 分液漏斗 分 离 硝 基 苯 与水 蒸馏 分离、提纯沸点相差 较大的混合溶液 蒸馏烧瓶、 冷凝管、 接收器 分 离 乙 醛 与 乙醇 洗气 分离、提 纯 气 体 混 合物 洗气装置 除去甲烷中的 乙烯 续表 分离、提纯 的方法 目的 主要仪器 实例 重结晶 分离、提 纯 固 体 混 合物 烧杯、 过滤器 提纯苯甲酸 渗析 除去胶体中的小分 子、离子 半透膜、 烧杯 除去淀粉中的 氯化钠、葡萄糖 2.常用分离和提纯方法的注意事项。 分离、 提纯方法 适用范围 注意事项 蒸馏 互溶的液体 各物质的沸点相差较大,一般在 30℃以上,热稳定性较好,冷却水 是下口进、上口出,加入沸石(碎瓷 片)可以防止暴沸,温度计水银球 位于蒸馏烧瓶支管口处 21

化学 选择性必修3有机化学基础 配人教版 续表 乙酸乙酯、 (a) 分离、 乙酸、乙醇 回乙酸、 适用范围 注意事项 硫酸钠【③) 提纯方法 混合物中各成分溶解度相差较大 b 重结晶 固态混合物 且被提纯物质的溶解度受温度影 ①: ;② :③ 响较大 A: :B: ;C: 答案a:饱和Na2CO3溶液b:H2SO,①:分液 ②:蒸馏③:蒸馏A:乙酸乙酯 B:乙酸钠、乙醇C:乙 从液体中 萃取剂的选择条件: 酸钠 萃取(主要 提纯液体 (1)与原溶剂互不相溶: 解析三者为互溶的液体,CH,COOCH2CH3在饱和 讨论液 有机化合 (2)被提纯物在此溶剂中的溶解度 Na2CO3溶液中溶解度不大,CH3COOH、CHCH2OH均易 液萃取) 物 大于在原溶剂中的溶解度 溶于水,故可先用饱和Na2CO3溶液分离出 CHCOOCH2CH3:乙醇、乙酸的沸点相差不大且互溶,故先 把CHCOOH转化为盐类,而后利用蒸饱法得到 3.结晶与重结晶。 CHCH2OH,最后将乙酸盐再转化为CH COOH,蒸馏 项目 结晶 重结晶 即可。 【例2】下列实验中,所采取的分离方法与对应原理都正 物质从溶液中以将晶体溶于溶剂,使之重 确的是( )。 含义 晶体形式析出的新从溶液中结晶析出的过 选项 目的 分离方法 原理 过程 程 碘在乙醇中的溶解度较 同相关操作 先蒸发,然后结晶 A 先溶解,然后结晶 分离溶于水的碳 乙醇萃取 大 使不纯净的物质纯化,或 分离乙酸乙酯和 乙酸乙酯和乙醇的密度 目的 获得结晶体 使混合在一起的物质彼此 分液 乙醇 不同 分离 除去KNO固体 NaCl在水中的溶解度 C 重结晶 操作方法相同,需要的仪器基本相同,均需要 中混杂的NaCI 很大 相同点 加热,最后都需要进行过滤 除去丁醇中的 蒸馏 丁醇与乙醚的沸点相差 D 思考发现 乙醚 较大 1.我国科学家屠呦呦因青蒿素研究获得诺贝尔生理学 答案D 或医学奖。她使用乙醚从中药青蒿中提取并分离出青蒿素。 解析分离溶于水的碘用萃取方法,但不能用乙醇作萃 上述描述中用乙醚提取青蒿素涉及的实验方法是什么?在 取剂,因乙醇和水互溶,可以选择难溶于水的苯、四氯化碳 化学实验室进行该操作需要的玻璃仪器有哪些? 等,A项错误:乙酸乙酯和己醇互溶,不能用分液法分离,可 提示实验方法是萃取,需要用到的玻璃仪器有分液漏 以利用乙醇易溶于水,乙酸乙酯在饱和碳酸钠溶液中溶解度 斗、烧杯等。 较小,加入饱和碳酸钠溶液振荡分层后再进行分液,B项错 2.粗苯甲酸样品中含有少量氯化钠和泥沙。通过重结 误;除去KNO3固体中混杂的NaCI可用结晶法,但利用的 晶的方法,可以提纯得到苯甲酸。提纯过程中,需要先加热 是氯化钠的溶解度随温度的变化不如硝酸钾的大,C项错 溶解苯甲酸,然后趁热过滤。溶解苯甲酸时加热的作用是什 误:丁醇和乙酰互溶,但两者沸点相差较大,可以采用蒸馏法 么?趁热过滤的目的又是什么? 进行分离,D项正确。 提示苯甲酸的溶解度随着温度升高而增大,加热可以 方法归纳 液体混合物分离方法的选择。 促进苯甲酸的溶解。趁热过滤是为了除去难溶性杂质,若第 一步所得到的是饱和溶液,过滤时因溶液的温度降低会析出 不互溶,分液 一部分溶质,造成损失。 两种 液体 沸点差别大,幕馏 典例剖析 互溶 沸点差别 不大 化学反应浦点差别大基循 【例1】现需分离乙酸乙酯、乙酸、乙醇的混合物,下图是 分离操作步骤流程图。请在图中圆括号内填入适当的试剂, 其中一种易蓬萃取、分液 于另一种溶剂 在方括号内填入适当的分离方法,在方框内填入所分离得到 的有关物质的名称。 22
化 学 选择性必修3 有机化学基础 配人教版 续表 分离、 提纯方法 适用范围 注意事项 重结晶 固态混合物 混合物中各成分溶解度相差较大, 且被提纯物质的溶解度受温度影 响较大 萃取(主要 讨论液- 液萃取) 从液体中 提纯液体 有机化合 物 萃取剂的选择条件: (1)与原溶剂互不相溶; (2)被提纯物在此溶剂中的溶解度 大于在原溶剂中的溶解度 3.结晶与重结晶。 项目 结晶 重结晶 不 同 点 含义 物质从溶液中以 晶体形式析出的 过程 将晶体溶于溶剂,使之重 新从溶液中结晶析出的过 程 相关操作 先蒸发,然后结晶 先溶解,然后结晶 目的 获得结晶体 使不纯净的物质纯化,或 使混合在一起的物质彼此 分离 相同点 操作方法相同,需要的仪器基本相同,均需要 加热,最后都需要进行过滤 1.我国科学家屠呦呦因青蒿素研究获得诺贝尔生理学 或医学奖。她使用乙醚从中药青蒿中提取并分离出青蒿素。 上述描述中用乙醚提取青蒿素涉及的实验方法是什么? 在 化学实验室进行该操作需要的玻璃仪器有哪些? 提示 实验方法是萃取,需要用到的玻璃仪器有分液漏 斗、烧杯等。 2.粗苯甲酸样品中含有少量氯化钠和泥沙。通过重结 晶的方法,可以提纯得到苯甲酸。提纯过程中,需要先加热 溶解苯甲酸,然后趁热过滤。溶解苯甲酸时加热的作用是什 么? 趁热过滤的目的又是什么? 提示 苯甲酸的溶解度随着温度升高而增大,加热可以 促进苯甲酸的溶解。趁热过滤是为了除去难溶性杂质,若第 一步所得到的是饱和溶液,过滤时因溶液的温度降低会析出 一部分溶质,造成损失。 典例剖析 【例1】现需分离乙酸乙酯、乙酸、乙醇的混合物,下图是 分离操作步骤流程图。请在图中圆括号内填入适当的试剂, 在方括号内填入适当的分离方法,在方框内填入所分离得到 的有关物质的名称。 $%$&、 $%、$( $%、 )%* C A B $( ! (a) (b) " [①] [②] [③] a: ;b: 。 ①: ;②: ;③: 。 A: ;B: ;C: 。 答案 a:饱和 Na2CO3 溶液 b:H2SO4 ①:分液 ②:蒸馏 ③:蒸馏 A:乙酸乙酯 B:乙酸钠、乙醇 C:乙 酸钠 解析 三者为互溶的液体,CH3COOCH2CH3 在饱和 Na2CO3 溶液中溶解度不大,CH3COOH、CH3CH2OH 均易 溶于水,故可先用饱和 Na2CO3 溶液分离出 CH3COOCH2CH3;乙醇、乙酸的沸点相差不大且互溶,故先 把CH3COOH 转化为盐类,而后利用蒸馏法得到 CH3CH2OH,最 后 将 乙 酸 盐 再 转 化 为 CH3COOH,蒸 馏 即可。 【例2】下列实验中,所采取的分离方法与对应原理都正 确的是( )。 选项 目的 分离方法 原理 A 分离溶于水的碘 乙醇萃取 碘在乙醇中的溶解度较 大 B 分离乙酸乙酯和 乙醇 分液 乙酸乙酯和乙醇的密度 不同 C 除去 KNO3 固体 中混杂的 NaCl 重结晶 NaCl在水中的溶解度 很大 D 除 去 丁 醇 中 的 乙醚 蒸馏 丁醇与乙醚的沸点相差 较大 答案 D 解析 分离溶于水的碘用萃取方法,但不能用乙醇作萃 取剂,因乙醇和水互溶,可以选择难溶于水的苯、四氯化碳 等,A项错误;乙酸乙酯和乙醇互溶,不能用分液法分离,可 以利用乙醇易溶于水,乙酸乙酯在饱和碳酸钠溶液中溶解度 较小,加入饱和碳酸钠溶液振荡分层后再进行分液,B项错 误;除去 KNO3 固体中混杂的 NaCl可用结晶法,但利用的 是氯化钠的溶解度随温度的变化不如硝酸钾的大,C项错 误;丁醇和乙醚互溶,但两者沸点相差较大,可以采用蒸馏法 进行分离,D项正确。 液体混合物分离方法的选择。 !"# 12 3, 24 $%&'( 56 "# $%&' !( $%&'( 789: 56 )*+,-# ;<、12 ./+,#0 22

第一章有机化合物的结构特点与研究方法 3.质谱法确定有机化合物相对分子质量:一般质谱图中 学以致用 的质荷比最大的值就是未知物的相对分子质量。 1,提纯下列物质(括号中为杂质),选择试剂和分离方法 4.确定分子式。 都正确的是( )。 (1)实验式法:即根据有机化合物中各元素的质量分数, 选项 被提纯的物质 除杂试剂 分离方法 然后得到该有机化合物中各原子的最简个数比,即得到实验 式(也称为最简式),然后用该有机化合物相对分子质量除以 A 酸性高锰 甲烷(乙烯) 该实验式的相对分子质量,即得到分子式。如某种有机化合 酸钾溶液 洗气 物的实验式为C2H,O(相对分子质量为44),该有机化合物 B 苯(硝基苯) 水 分液 的相对分子质量为88,则说明该有机化合物的分子式为 饱和碳酸 C4HsO2。 c 乙酸乙酯(乙酸) 分液 钠溶液 (2)余数法:如果该有机化合物为烃,在已经知道相对分 子质量的情况下,可以用以下方法确定分子式。 D 硝酸钾(氯化钠) 水 萃取 用烃的相对分子质量除以14,看商数和余数。 答案C M,(C,H2_M,CH2=A… 解析乙烯被高锰酸钾氧化生成二氧化碳,会引入新杂 M.(CH) 14 余2为烷烃 质,应用溴水洗气除杂,故A项错误:苯和硝基苯互溶,且都 除尽为烯烃或环烷烃 难溶于水,分液无法除杂,故B项错误:乙酸与碳酸钠反应 后易溶于水,乙酸乙酯与碳酸钠溶液分层,然后分液可除杂, 差2为炔烃或二烯烃等 差6为苯或苯的同系物等 故C项正确:硝酸钾和氯化钠均溶于水,可用重结晶的方法 其中商数A为烃中的碳原子数,此法适用于具有特定 分离,故D项错误。 通式的烃(如烷烃、烯烃、炔烃、苯、苯的同系物等)。 2.下列有关实验的说法中错误的是()。 如某有机化合物为烃类,且相对分子质量为58,则58 A在蒸馏的实验中,温度计的水银球位于支管口处是 除以14,商4余2,则该有机化合物的分子式为烷烃,即为 为了测出馏分的沸点 B.工业乙醇用直接蒸馏的方法不能得到无水乙醇 CiHio C.在重结品的实验中,使用短颈漏斗趁热过滤是为了 ”思考发现 减少被提纯物质的损失 1.我国科学家屠呦呦因发现治疗疟疾的特效药一青 D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度 蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素来源于 受温度影响应该很大 植物青蒿,其分子式是CsH2O,其结构简式如下图所示: 答案D 解析重结晶要选择适当的溶剂,该溶剂要求杂质在此 溶剂中的溶解度很小或溶解度很大,易于除去。D项错误。 二有机化合物分子式的确定 重难归纳 1,4步确定有机化合物的分子式。 已知青蒿素完全燃烧的产物只有CO2和H2O,如何通 第1步,定元素。若某有机化合物完全燃烧的产物仅为 过实验判断该有机化合物中是否含有氧元素? CO2和H2O,则说明该有机化合物中一定含有碳和氢两种 提示先根据燃烧产物CO2和H2O的质量计算出碳 元素。若需确定是否含有氧元素,则要进一步实验确定。第 元素和氢元素质量,若m(C)十m(H)=m(有机化合物),则 2步,算出最简式(实验式)。第3步,确定相对分子质量。 不含有氧元素:若m(C)十m(H)<m(有机化合物),说明含 第4步,求出分子式。 有氧元素,则m(O)=m(有机化合物)一m(C)一m(HD。 2.有机化合物完全燃烧的产物仅为CO2和H2O,确定 2.有机化合物的实验式和分子式有何异同?试分析能 是否含有氧元素的方法:通过相关的实验可以先确定CO2 否由实验式直接确定分子式? 和H,O的质量,进而求得该有机化合物中所含碳元素和氢 提示实验式也叫“最简式”,表示最简单的原子个数比, 元素的质量。m(C)=2 1×2(co2),m(H)=3× 而分子式表明了一个分子中的所含各元素原子的个数,有些 物质的实验式和分子式相同,如CH,大多数有机化合物则不 m(H2O)。若m(有机化合物)=m(C)十m(H),则说明该 同,如乙烯的分子式是C2H,实验式是CH2。有些实验式可 有机化合物中只含C和H两种元素。若(有机化合物)> 以直接确定分子式,有些不可以。如实验式CH4、CHO、 m(C)十m(H),且完全燃烧只生成CO2和H2O,则说明有 CH3、C2HO、CHO等,根据氢原子饱和程度知对应的分子式 机化合物中含有C、H、O三种元素,其中m(O)=m(有机化 只有CH4、CHO、C2H、C2HO,C2HO2,但绝大多数实验式 合物)-m(C)-m(H)。 无法直接确定分子式。 23
第一章 有机化合物的结构特点与研究方法 学以致用 1.提纯下列物质(括号中为杂质),选择试剂和分离方法 都正确的是( )。 选项 被提纯的物质 除杂试剂 分离方法 A 甲烷(乙烯) 酸性高锰 酸钾溶液 洗气 B 苯(硝基苯) 水 分液 C 乙酸乙酯(乙酸) 饱和碳酸 钠溶液 分液 D 硝酸钾(氯化钠) 水 萃取 答案 C 解析 乙烯被高锰酸钾氧化生成二氧化碳,会引入新杂 质,应用溴水洗气除杂,故 A项错误;苯和硝基苯互溶,且都 难溶于水,分液无法除杂,故 B项错误;乙酸与碳酸钠反应 后易溶于水,乙酸乙酯与碳酸钠溶液分层,然后分液可除杂, 故C项正确;硝酸钾和氯化钠均溶于水,可用重结晶的方法 分离,故D项错误。 2.下列有关实验的说法中错误的是( )。 A.在蒸馏的实验中,温度计的水银球位于支管口处是 为了测出馏分的沸点 B.工业乙醇用直接蒸馏的方法不能得到无水乙醇 C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了 减少被提纯物质的损失 D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度 受温度影响应该很大 答案 D 解析 重结晶要选择适当的溶剂,该溶剂要求杂质在此 溶剂中的溶解度很小或溶解度很大,易于除去。D项错误。 二 有机化合物分子式的确定 重难归纳 1.4步确定有机化合物的分子式。 第1步,定元素。若某有机化合物完全燃烧的产物仅为 CO2 和 H2O,则说明该有机化合物中一定含有碳和氢两种 元素。若需确定是否含有氧元素,则要进一步实验确定。第 2步,算出最简式(实验式)。第3步,确定相对分子质量。 第4步,求出分子式。 2.有机化合物完全燃烧的产物仅为CO2 和 H2O,确定 是否含有氧元素的方法:通过相关的实验可以先确定 CO2 和 H2O的质量,进而求得该有机化合物中所含碳元素和氢 元素 的 质 量。m (C)= 12 44 ×m (CO2 ),m(H)= 2 18 × m(H2O)。若m(有机化合物)=m(C)+m(H),则说明该 有机化合物中只含C和 H 两种元素。若m(有机化合物)> m(C)+m(H),且完全燃烧只生成 CO2 和 H2O,则说明有 机化合物中含有C、H、O三种元素,其中m(O)=m(有机化 合物)-m(C)-m(H)。 3.质谱法确定有机化合物相对分子质量:一般质谱图中 的质荷比最大的值就是未知物的相对分子质量。 4.确定分子式。 (1)实验式法:即根据有机化合物中各元素的质量分数, 然后得到该有机化合物中各原子的最简个数比,即得到实验 式(也称为最简式),然后用该有机化合物相对分子质量除以 该实验式的相对分子质量,即得到分子式。如某种有机化合 物的实验式为C2H4O(相对分子质量为44),该有机化合物 的相对分子质量为88,则说明该有机化合物的分子式为 C4H8O2。 (2)余数法:如果该有机化合物为烃,在已经知道相对分 子质量的情况下,可以用以下方法确定分子式。 用烃的相对分子质量除以14,看商数和余数。 Mr(CxHy) Mr(CH2)= Mr(CxHy) 14 =A…… 余2 为烷烃 除尽 为烯烃或环烷烃 差2 为炔烃或二烯烃等 差6 为苯或苯的同系物等 其中商数A 为烃中的碳原子数,此法适用于具有特定 通式的烃(如烷烃、烯烃、炔烃、苯、苯的同系物等)。 如某有机化合物为烃类,且相对分子质量为58,则58 除以14,商4余2,则该有机化合物的分子式为烷烃,即为 C4H10。 1.我国科学家屠呦呦因发现治疗疟疾的特效药———青 蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素来源于 植物青蒿,其分子式是C15H22O5,其结构简式如下图所示: O O O O O 已知青蒿素完全燃烧的产物只有CO2 和 H2O,如何通 过实验判断该有机化合物中是否含有氧元素? 提示 先根据燃烧产物 CO2 和 H2O 的质量计算出碳 元素和氢元素质量,若m(C)+m(H)=m(有机化合物),则 不含有氧元素;若m(C)+m(H)<m(有机化合物),说明含 有氧元素,则m(O)=m(有机化合物)-m(C)-m(H)。 2.有机化合物的实验式和分子式有何异同? 试分析能 否由实验式直接确定分子式? 提示 实验式也叫“最简式”,表示最简单的原子个数比, 而分子式表明了一个分子中的所含各元素原子的个数,有些 物质的实验式和分子式相同,如CH4,大多数有机化合物则不 同,如乙烯的分子式是C2H4,实验式是CH2。有些实验式可 以直接确定分子式,有些不可以。如实验式 CH4、CH4O、 CH3、C2H6O、CH3O等,根据氢原子饱和程度知对应的分子式 只有CH4、CH4O、C2H6、C2H6O、C2H6O2,但绝大多数实验式 无法直接确定分子式。 23
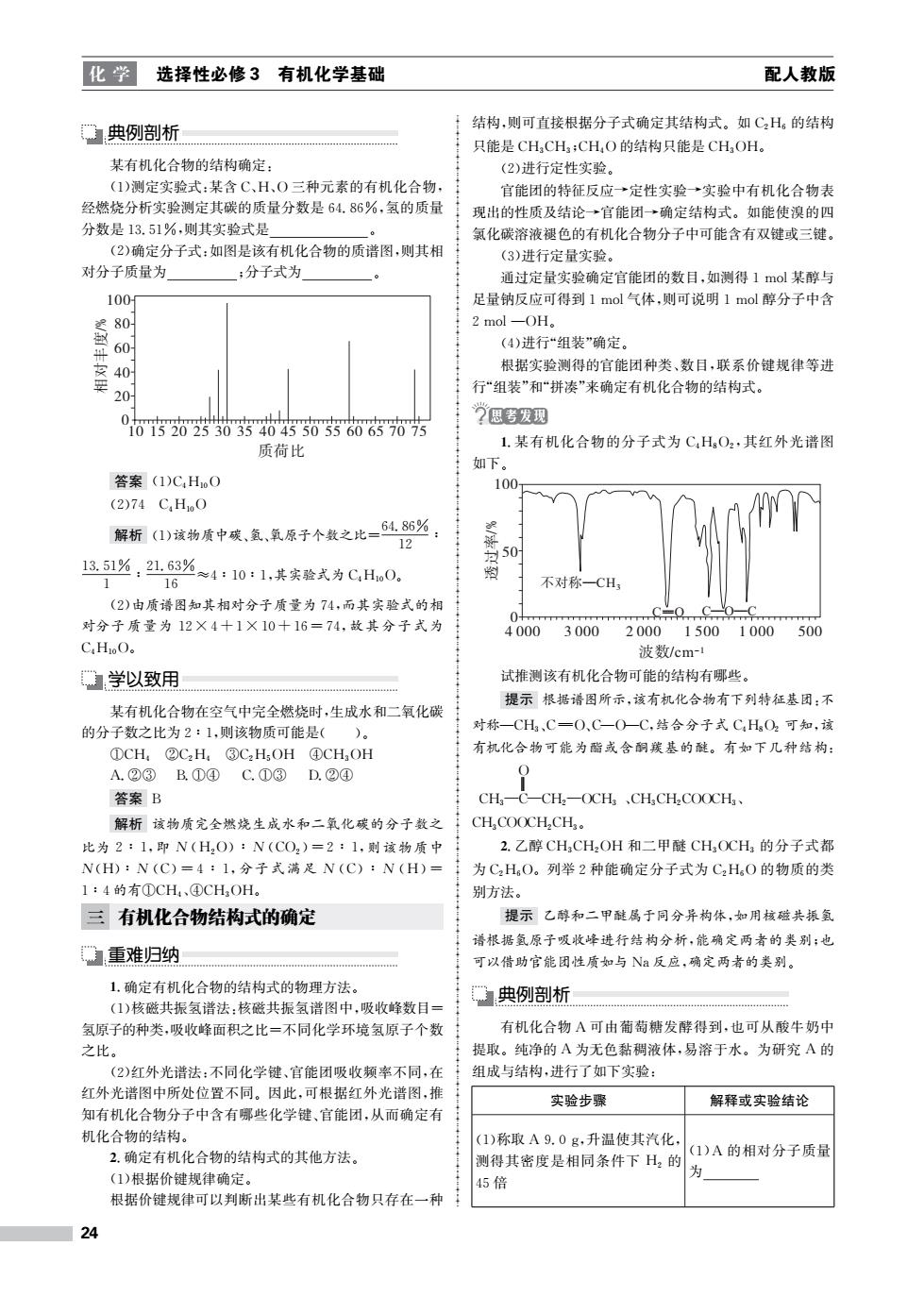
化学 选择性必修3 有机化学基础 配人教版 典例剖析 结构,则可直接根据分子式确定其结构式。如C,H。的结构 只能是CHCH:CHO的结构只能是CHOH。 某有机化合物的结构确定: (2)进行定性实验。 (1)测定实验式:某含C、H、O三种元素的有机化合物, 官能团的特征反应→定性实验→实验中有机化合物表 经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量 现出的性质及结论→官能团→确定结构式。如能使溴的四 分数是13.51%,则其实验式是 0 氯化碳溶液褪色的有机化合物分子中可能含有双键或三键。 (2)确定分子式:如图是该有机化合物的质谱图,则其相 (3)进行定量实验。 对分子质量为 :分子式为 通过定量实验确定官能团的数目,如测得1mol某醇与 100 足量钠反应可得到1mol气体,则可说明1mol醇分子中含 80 2mol-OH。 60 (4)进行“组装”确定。 0 根据实验测得的官能团种类、数目,联系价键规律等进 20 行“组装”和“拼凑”来确定有机化合物的结构式。 0 ”思考发现 质荷比 1.某有机化合物的分子式为CHO2,其红外光谱图 如下。 答案(1)C,HoO 100 (2)74C4HoO 解析(1)该物质中残、氯,氧原子个数之比=6486必 12 13.51%,21,63%≈4:10:1,其实验式为C,H0。 1 16 不对称一CH (2)由质语图知其相对分子质量为74,而其实验式的相 0 C=0C0 对分子质量为12×4十1×10十16=74,故其分子式为 4000 3000 200015001000 500 C,HoO。 波数/cm- 学以致用 试推测该有机化合物可能的结构有哪些。 提示根据谱图所示,该有机化合物有下列特征基团:不 某有机化合物在空气中完全燃烧时,生成水和二氧化碳 的分子数之比为2:1,则该物质可能是()。 对称—CH3、C=O、C一O一C,结合分子式C4HO2可知,该 ①CH,②CzH,③CzH,OH④CHOH 有机化合物可能为酯或含酮羰基的酰醚。有如下几种结构: A.②③B.①④C.①③ D.②④ 答案B CH—C CH2-OCH,CHCH2 COOCH、 解析该物质完全燃烧生成水和二氧化碳的分子数之 CH,COOCH2CH3。 比为2:1,即N(H2O):V(CO2)=2:1,则该物质中 2.乙醇CHCH2OH和二甲醚CH,OCH的分子式都 N(H):N(C)=4:1,分子式满足N(C):N(H)= 为CzHO。列举2种能确定分子式为C2H,O的物质的类 1:4的有①CH4、④CHOH. 别方法。 三有机化合物结构式的确定 提示乙醇和二甲酰属于同分异构体,如用核磁共振氨 谱根据氢原子吸收峰进行结构分析,能确定两者的类别:也 重难归纳 可以借助官能团性质如与N反应,确定两者的类别。 1.确定有机化合物的结构式的物理方法。 典例剖析 (1)核磁共振氢谱法:核磁共振氢谱图中,吸收峰数目= 氢原子的种类,吸收峰面积之比=不同化学环境氢原子个数 有机化合物A可由葡萄糖发酵得到,也可从酸牛奶中 之比。 提取。纯净的A为无色黏稠液体,易溶于水。为研究A的 (2)红外光谱法:不同化学键、官能团吸收频率不同,在 组成与结构,进行了如下实验: 红外光谱图中所处位置不同。因此,可根据红外光谱图,推 实验步骤 解释或实验结论 知有机化合物分子中含有哪些化学键、官能团,从而确定有 机化合物的结构。 (1)称取A9.0g,升温使其汽化, 2.确定有机化合物的结构式的其他方法。 (1)A的相对分子质量 测得其密度是相同条件下H2的 (1)根据价键规律确定。 为 45倍 根据价键规律可以判断出某些有机化合物只存在一种 24
化 学 选择性必修3 有机化学基础 配人教版 典例剖析 某有机化合物的结构确定: (1)测定实验式:某含C、H、O三种元素的有机化合物, 经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量 分数是13.51%,则其实验式是 。 (2)确定分子式:如图是该有机化合物的质谱图,则其相 对分子质量为 ;分子式为 。 !"# 100 80 60 40 20 0 10 15 20 25 30 35 40 45 50 55 60 65 70 75 $ % & '/% 答案 (1)C4H10O (2)74 C4H10O 解析 (1)该物质中碳、氢、氧原子个数之比= 64.86% 12 ∶ 13.51% 1 ∶ 21.63% 16 ≈4∶10∶1,其实验式为C4H10O。 (2)由质谱图知其相对分子质量为74,而其实验式的相 对分子质量为 12×4+1×10+16=74,故其分子式为 C4H10O。 学以致用 某有机化合物在空气中完全燃烧时,生成水和二氧化碳 的分子数之比为2∶1,则该物质可能是( )。 ①CH4 ②C2H4 ③C2H5OH ④CH3OH A.②③ B.①④ C.①③ D.②④ 答案 B 解析 该物质完全燃烧生成水和二氧化碳的分子数之 比为2∶1,即 N (H2O)∶N (CO2)=2∶1,则该物质中 N(H)∶N (C)=4∶1,分子式满足 N (C)∶N (H)= 1∶4的有①CH4、④CH3OH。 三 有机化合物结构式的确定 重难归纳 1.确定有机化合物的结构式的物理方法。 (1)核磁共振氢谱法:核磁共振氢谱图中,吸收峰数目= 氢原子的种类,吸收峰面积之比=不同化学环境氢原子个数 之比。 (2)红外光谱法:不同化学键、官能团吸收频率不同,在 红外光谱图中所处位置不同。因此,可根据红外光谱图,推 知有机化合物分子中含有哪些化学键、官能团,从而确定有 机化合物的结构。 2.确定有机化合物的结构式的其他方法。 (1)根据价键规律确定。 根据价键规律可以判断出某些有机化合物只存在一种 结构,则可直接根据分子式确定其结构式。如C2H6 的结构 只能是CH3CH3;CH4O的结构只能是CH3OH。 (2)进行定性实验。 官能团的特征反应→定性实验→实验中有机化合物表 现出的性质及结论→官能团→确定结构式。如能使溴的四 氯化碳溶液褪色的有机化合物分子中可能含有双键或三键。 (3)进行定量实验。 通过定量实验确定官能团的数目,如测得1mol某醇与 足量钠反应可得到1mol气体,则可说明1mol醇分子中含 2mol—OH。 (4)进行“组装”确定。 根据实验测得的官能团种类、数目,联系价键规律等进 行“组装”和“拼凑”来确定有机化合物的结构式。 1.某有机化合物的分子式为 C4H8O2,其红外光谱图 如下。 !"#—CH3 C——O C—O—C 4 000 3 000 2 000 1 500 1 000 500 100 50 %&/cm-1 ' ( )/% 0 试推测该有机化合物可能的结构有哪些。 提示 根据谱图所示,该有机化合物有下列特征基团:不 对称—CH3、CO、C—O—C,结合分子式C4H8O2 可知,该 有机化合物可能为酯或含酮羰基的醚。有如下几种结构: CH3 C O CH2 OCH3 、CH3CH2COOCH3、 CH3COOCH2CH3。 2.乙醇CH3CH2OH 和二甲醚 CH3OCH3 的分子式都 为C2H6O。列举2种能确定分子式为 C2H6O 的物质的类 别方法。 提示 乙醇和二甲醚属于同分异构体,如用核磁共振氢 谱根据氢原子吸收峰进行结构分析,能确定两者的类别;也 可以借助官能团性质如与 Na反应,确定两者的类别。 典例剖析 有机化合物 A可由葡萄糖发酵得到,也可从酸牛奶中 提取。纯净的 A为无色黏稠液体,易溶于水。为研究 A 的 组成与结构,进行了如下实验: 实验步骤 解释或实验结论 (1)称取 A9.0g,升温使其汽化, 测得其密度是相同条件下 H2 的 45倍 (1)A 的相对分子质量 为 24
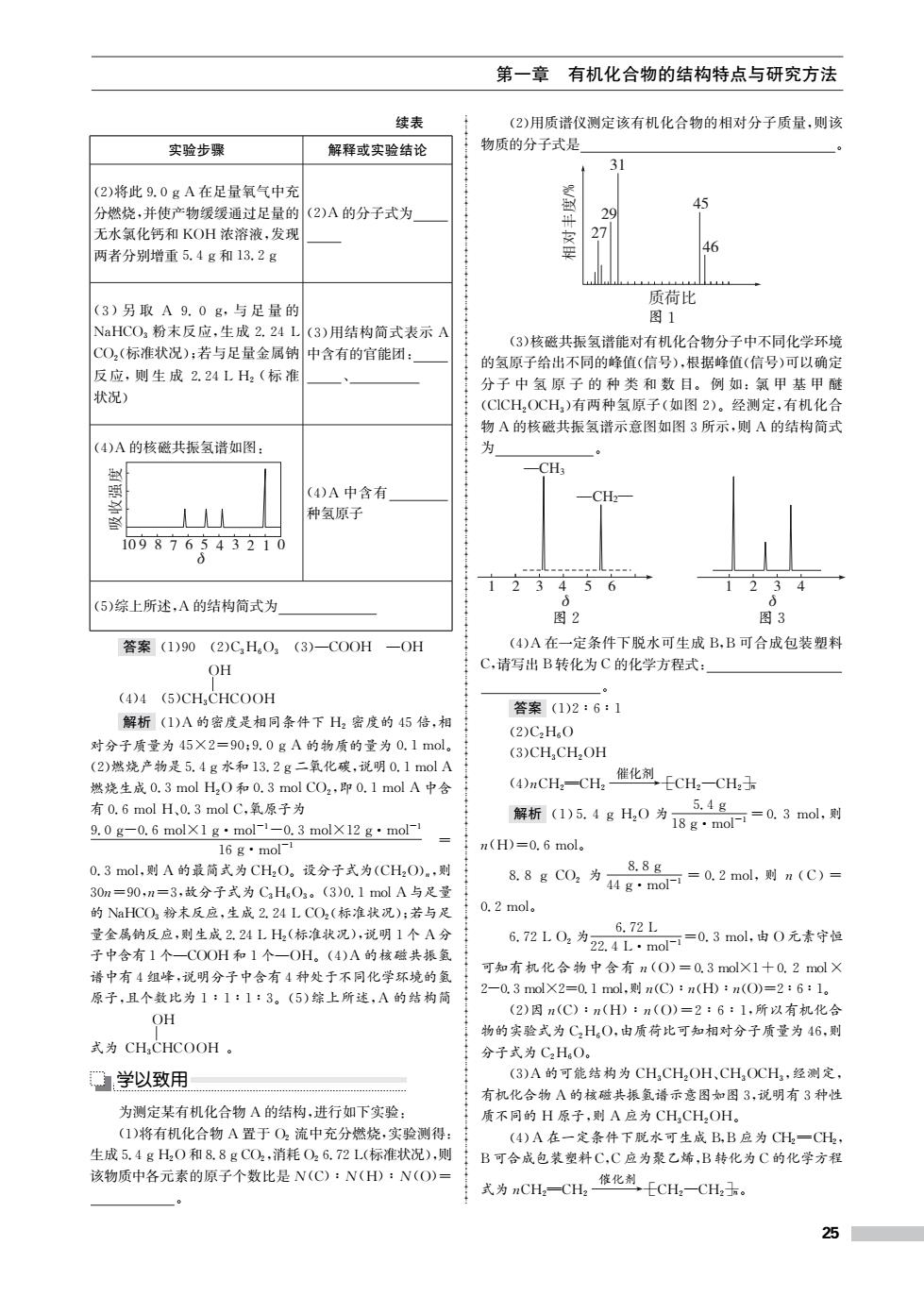
第一章有机化合物的结构特点与研究方法 续表 (2)用质谱仪测定该有机化合物的相对分子质量,则该 实验步骤 解释或实验结论 物质的分子式是 31 (2)将此9.0gA在足量氧气中充 分燃烧,并使产物缓缓通过足量的(2)A的分子式为 45 无水氯化钙和KOH浓溶液,发现 27 两者分别增重5.4g和13.2g 46 质荷比 (3)另取A9.0g,与足量的 图1 NaHCO3粉末反应,生成2.24L(3)用结构简式表示A (3)核磁共振氢谱能对有机化合物分子中不同化学环境 CO,(标准状况):若与足量金属钠中含有的官能团: 的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定 反应,则生成2.24LH2(标准 分子中氢原子的种类和数目。例如:氯甲基甲醚 状况) (CICH2OCH,)有两种氢原子(如图2)。经测定,有机化合 物A的核磁共振氢谱示意图如图3所示,则A的结构简式 (4)A的核磁共振氢谱如图: 为 -CH (4)A中含有 CH 种氢原子 109876543210 d 12345 (5)综上所述,A的结构简式为 图2 图3 答案(1)90(2)C,H,02(3)-COOH -OH (4)A在一定条件下脱水可生成B,B可合成包装塑料 OH C,请写出B转化为C的化学方程式: (4)4 (5)CHCHCOOH 答案(1)2:6:1 解析(1)A的密度是相同条件下H2密度的45倍,相 (2)C2H.O 对分子质量为45X2=90:9.0gA的物质的量为0.1mol。 (3)CH,CHOH (2)燃烧产物是5.4g水和13.2g二氧化碳,说明0.1molA 燃烧生成0.3molH20和0.3 mol CO2,即0.1molA中含 (AmCH,-CH,雀化剂FCH,-CH,3 有0.6molH、0.3molC,氧原子为 5.4g 9.0g-0.6molX1g·mol-1-0.3molX12g·mol-1 解析1)5.4gH0为18g:mo=0.3mo.则 16g·mol- n(H)=0.6mol。 0.3mol,则A的最简式为CH2O。设分子式为(CH2O)m,则 8.8g 30m=90,n=3,故分子式为CaHO3。(3)0.1molA与足量 88gCc0,为4g,moF=0.2mo,则n(C)= 的NaHCO3粉末反应,生成2.24LCO2(标准状况):若与足 0.2mol。 量金属钠反应,则生成2.24LH2(标准状况),说明1个A分 6.72L 6.72L0,为2.4Lm0可=0.3mol,由0元素守恒 子中含有1个一COOH和1个一OH。(4)A的核磁共振氢 可知有机化合物中含有n(O)=0.3molX1+0.2molX 谱中有4组峰,说明分子中含有4种处于不同化学环境的氢 原子,且个数比为1:1:1:3。(5)综上所述,A的结构简 2-0.3molX2=0.1mol,则n(C):n(H):n(O)=2:6:1。 OH (2)因n(C):n(H):n(O)=2:6:1,所以有机化合 物的实验式为C,H,O,由质荷比可知相对分子质量为46,则 式为CH CHCOOH。 分子式为C2HO。 学以致用 (3)A的可能结构为CH,CH2OH、CH,OCH,经测定, 有机化合物A的核磁共振氢谱示意图如图3,说明有3种性 为测定某有机化合物A的结构,进行如下实验: 质不同的H原子,则A应为CHCH,OH。 (1)将有机化合物A置于O2流中充分燃烧,实验测得: (4)A在一定条件下脱水可生成B,B应为CH2=CH 生成5.4gH20和8.8gCO2,消耗O26.72L(标准状况),则 B可合成包装塑料C,C应为聚乙烯,B转化为C的化学方程 该物质中各元素的原子个数比是N(C):N(H):N(O)= 式为nCH,=CH,修化剂ECH,-CH,。 25
第一章 有机化合物的结构特点与研究方法 续表 实验步骤 解释或实验结论 (2)将此9.0gA在足量氧气中充 分燃烧,并使产物缓缓通过足量的 无水氯化钙和 KOH 浓溶液,发现 两者分别增重5.4g和13.2g (2)A的分子式为 (3)另 取 A 9.0 g,与 足 量 的 NaHCO3 粉末反应,生成2.24L CO2(标准状况);若与足量金属钠 反应,则 生 成 2.24LH2 (标 准 状况) (3)用结构简式表示 A 中含有的官能团: 、 (4)A的核磁共振氢谱如图: 10 9 8 7 6 5 4 3 2 1 0 ! " # $ d (4)A 中含有 种氢原子 (5)综上所述,A的结构简式为 答案 (1)90 (2)C3H6O3 (3)—COOH —OH (4)4 (5)CH3CHCOOH OH 解析 (1)A的密度是相同条件下 H2 密度的45倍,相 对分子质量为45×2=90;9.0gA的物质的量为0.1mol。 (2)燃烧产物是5.4g水和13.2g二氧化碳,说明0.1molA 燃烧生成0.3molH2O和0.3molCO2,即0.1molA中含 有0.6molH、0.3molC,氧原子为 9.0g-0.6mol×1g·mol-1-0.3mol×12g·mol-1 16g·mol-1 = 0.3mol,则A的最简式为CH2O。设分子式为(CH2O)n,则 30n=90,n=3,故分子式为C3H6O3。(3)0.1molA与足量 的NaHCO3 粉末反应,生成2.24LCO2(标准状况);若与足 量金属钠反应,则生成2.24LH2(标准状况),说明1个 A分 子中含有1个—COOH和1个—OH。(4)A 的核磁共振氢 谱中有4组峰,说明分子中含有4种处于不同化学环境的氢 原子,且个数比为1∶1∶1∶3。(5)综上所述,A 的结构简 式为 CH3CHCOOH OH 。 学以致用 为测定某有机化合物 A的结构,进行如下实验: (1)将有机化合物 A置于 O2 流中充分燃烧,实验测得: 生成5.4gH2O和8.8gCO2,消耗O26.72L(标准状况),则 该物质中各元素的原子个数比是N(C)∶N(H)∶N(O)= 。 (2)用质谱仪测定该有机化合物的相对分子质量,则该 物质的分子式是 。 27 29 45 46 31 %&' ! " # $/% 图1 (3)核磁共振氢谱能对有机化合物分子中不同化学环境 的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定 分子 中 氢 原 子 的 种 类 和 数 目。 例 如:氯 甲 基 甲 醚 (ClCH2OCH3)有两种氢原子(如图2)。经测定,有机化合 物 A的核磁共振氢谱示意图如图3所示,则 A的结构简式 为 。 3 4 5 6 d —CH3 —CH2— 1 2 图2 1 2 3 4 d 图3 (4)A在一定条件下脱水可生成B,B可合成包装塑料 C,请写出B转化为C的化学方程式: 。 答案 (1)2∶6∶1 (2)C2H6O (3)CH3CH2OH (4)nCH2CH2 催化剂 →CH2—CH2 解析 (1)5.4g H2O 为 5.4g 18g·mol-1 =0.3 mol,则 n(H)=0.6mol。 8.8g CO2 为 8.8g 44g·mol-1 =0.2mol,则 n(C)= 0.2mol。 6.72LO2 为 6.72L 22.4L·mol-1=0.3mol,由 O元素守恒 可知有机化合物中含有n(O)=0.3mol×1+0.2 mol× 2-0.3mol×2=0.1mol,则n(C)∶n(H)∶n(O)=2∶6∶1。 (2)因n(C)∶n(H)∶n(O)=2∶6∶1,所以有机化合 物的实验式为C2H6O,由质荷比可知相对分子质量为46,则 分子式为C2H6O。 (3)A的可能结构为 CH3CH2OH、CH3OCH3,经测定, 有机化合物 A的核磁共振氢谱示意图如图3,说明有3种性 质不同的 H 原子,则 A应为CH3CH2OH。 (4)A在一定条件下脱水可生成B,B应为CH2CH2, B可合成包装塑料C,C应为聚乙烯,B转化为C的化学方程 式为nCH2CH2 催化剂 →CH2—CH2。 25