
● 同族元素自上而下形成族氧化态的趋势增强 ● 需要指出的是,这条规律对第3族 和第12族 表现不明显 3. 同族元素族氧化态稳定性变化趋势
● 同族元素自上而下形成族氧化态的趋势增强 ● 需要指出的是,这条规律对第3族 和第12族 表现不明显 3. 同族元素族氧化态稳定性变化趋势

为什么 p 区元素氧化数的改变往 往是不连续的,而 d 区元素往往是连 续的? ● d 区元素增加的电子填充在 d 轨道,d 与 s 轨道接 近 ,d 电子可逐个地参加成键 ● p 区元素除了单个 p 电子首先参与成键外,还可 依次拆开成对的 p 电子,甚至 ns 2电子对,氧化数总 是增加 2 Question 3 Solution
为什么 p 区元素氧化数的改变往 往是不连续的,而 d 区元素往往是连 续的? ● d 区元素增加的电子填充在 d 轨道,d 与 s 轨道接 近 ,d 电子可逐个地参加成键 ● p 区元素除了单个 p 电子首先参与成键外,还可 依次拆开成对的 p 电子,甚至 ns 2电子对,氧化数总 是增加 2 Question 3 Solution

随周期性的增加,为什么主族元素 低氧化态趋于稳定,而过渡元素高氧化 态趋于稳定? ● 主族因 “惰性电子对效应” ● 过渡元素是 I1和 I2往往是第 二、三 过渡系列比第 一 大 , 但从 I3开始 ,往往相反: (I1+I2)/MJ · mol-1 (I3+I4)/MJ · mol-1 Ni 2.49 8.69 Pt 2.66 6.70 Question 4 Solution
随周期性的增加,为什么主族元素 低氧化态趋于稳定,而过渡元素高氧化 态趋于稳定? ● 主族因 “惰性电子对效应” ● 过渡元素是 I1和 I2往往是第 二、三 过渡系列比第 一 大 , 但从 I3开始 ,往往相反: (I1+I2)/MJ · mol-1 (I3+I4)/MJ · mol-1 Ni 2.49 8.69 Pt 2.66 6.70 Question 4 Solution
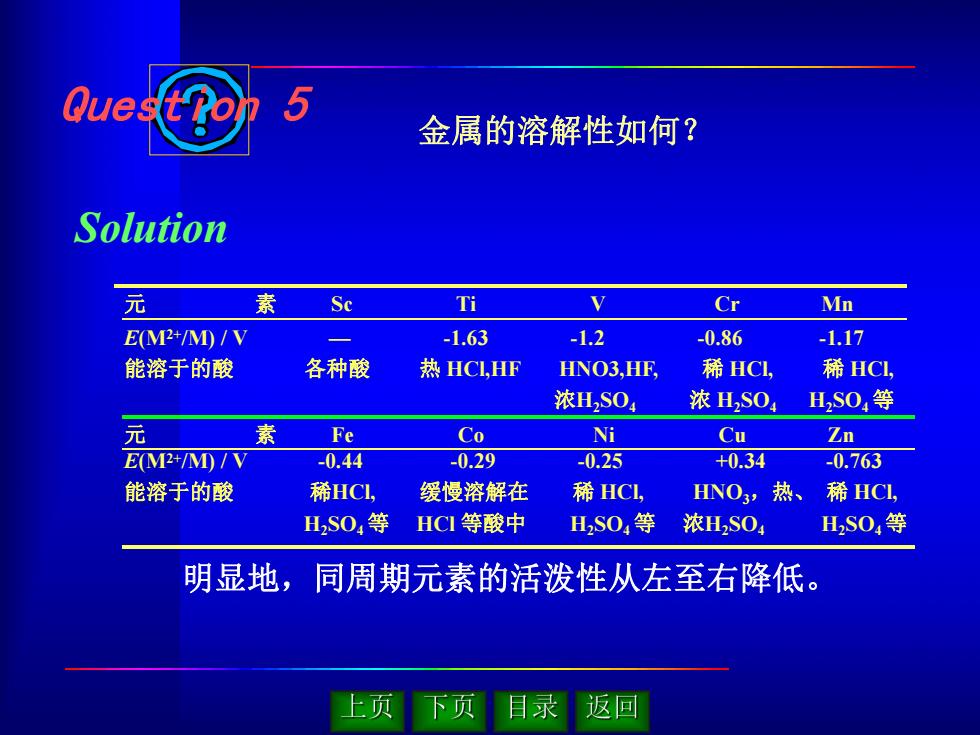
明显地,同周期元素的活泼性从左至右降低。 E(M2+/M) / V — -1.63 -1.2 -0.86 -1.17 能溶于的酸 各种酸 热 HCl,HF HNO3,HF, 稀 HCl, 稀 HCl, 浓H2SO4 浓 H2SO4 H2SO4等 元 素 Sc Ti V Cr Mn 元 素 Fe Co Ni Cu Zn E(M2+/M) / V -0.44 -0.29 -0.25 +0.34 -0.763 能溶于的酸 稀HCl, 缓慢溶解在 稀 HCl, HNO3,热、 稀 HCl, H2SO4等 HCl 等酸中 H2SO4等 浓H2SO4 H2SO4等 Question 5 Solution 金属的溶解性如何?
明显地,同周期元素的活泼性从左至右降低。 E(M2+/M) / V — -1.63 -1.2 -0.86 -1.17 能溶于的酸 各种酸 热 HCl,HF HNO3,HF, 稀 HCl, 稀 HCl, 浓H2SO4 浓 H2SO4 H2SO4等 元 素 Sc Ti V Cr Mn 元 素 Fe Co Ni Cu Zn E(M2+/M) / V -0.44 -0.29 -0.25 +0.34 -0.763 能溶于的酸 稀HCl, 缓慢溶解在 稀 HCl, HNO3,热、 稀 HCl, H2SO4等 HCl 等酸中 H2SO4等 浓H2SO4 H2SO4等 Question 5 Solution 金属的溶解性如何?

为什么Ti、Zr 和 Hf 不溶于稀 HCl、 稀 H2SO4或 HNO3,却很容易溶于 酸性较 弱的 HF 中? 可从下面的电极电势和两个反应进行解释: 破坏氧化膜 MO2 + 4HF → H2[MF6] + 2H2O 金 属 溶 解 M + 6HF + 4HNO3 → H2[MF6] + 4NO2 + 2H2O Question 6 Solution TiO2 + 4H+ + 4e - Ti + 2H2O Eq = -0.86V ZnO2 + 4H+ + 4e - Zr + 2H2O Eq = -1.43V HfO2 + 4H+ + 4e - Hf + 2H2O Eq = -1.57V
为什么Ti、Zr 和 Hf 不溶于稀 HCl、 稀 H2SO4或 HNO3,却很容易溶于 酸性较 弱的 HF 中? 可从下面的电极电势和两个反应进行解释: 破坏氧化膜 MO2 + 4HF → H2[MF6] + 2H2O 金 属 溶 解 M + 6HF + 4HNO3 → H2[MF6] + 4NO2 + 2H2O Question 6 Solution TiO2 + 4H+ + 4e - Ti + 2H2O Eq = -0.86V ZnO2 + 4H+ + 4e - Zr + 2H2O Eq = -1.43V HfO2 + 4H+ + 4e - Hf + 2H2O Eq = -1.57V