
● 晶格缺陷 晶格缺陷一种是晶格中某些负离子没有,空位由自由 电子占据,以此达到电荷平衡;第二种是晶体中金属离 子过剩,占据晶格间隙位置,电荷由占据另一些间隙位 置的电子来平衡。两种缺陷中都包含自由电子,被激发 所需的能量一般较小,若吸收峰落在可见光区,就现出 颜色。 SnI4的电荷迁移
● 晶格缺陷 晶格缺陷一种是晶格中某些负离子没有,空位由自由 电子占据,以此达到电荷平衡;第二种是晶体中金属离 子过剩,占据晶格间隙位置,电荷由占据另一些间隙位 置的电子来平衡。两种缺陷中都包含自由电子,被激发 所需的能量一般较小,若吸收峰落在可见光区,就现出 颜色。 SnI4的电荷迁移

因电荷迁移而显色的化合物颇多. 请解 释:(1) d 轨道全空, 或者全满的化合物 能否发生 d–d 跃迁? (2) 同样是锡的卤化物的 SnF4 , SnCl4 和 SnBr4为什么均不显色? (1) 显然是不可能的; (2) 由于 SnF4等基本上保持离子状态 , 要使 F-的电子跃 迁到 Sn 4+ , 必须提供较高的能量 , 只有吸收波长很短 的光 (紫外光) 才能达到。 I -较易变形 , 在 Sn 4+的极 化下, 电子云已强烈地向 Sn 4+偏移 , 实现电荷迁移 就比较容易 , 会使吸 收峰由紫外区移向可见光区。 Question 2 Solution
因电荷迁移而显色的化合物颇多. 请解 释:(1) d 轨道全空, 或者全满的化合物 能否发生 d–d 跃迁? (2) 同样是锡的卤化物的 SnF4 , SnCl4 和 SnBr4为什么均不显色? (1) 显然是不可能的; (2) 由于 SnF4等基本上保持离子状态 , 要使 F-的电子跃 迁到 Sn 4+ , 必须提供较高的能量 , 只有吸收波长很短 的光 (紫外光) 才能达到。 I -较易变形 , 在 Sn 4+的极 化下, 电子云已强烈地向 Sn 4+偏移 , 实现电荷迁移 就比较容易 , 会使吸 收峰由紫外区移向可见光区。 Question 2 Solution

15.1.3 氧化态 多种氧化态 导致丰富的氧化还原行为
15.1.3 氧化态 多种氧化态 导致丰富的氧化还原行为
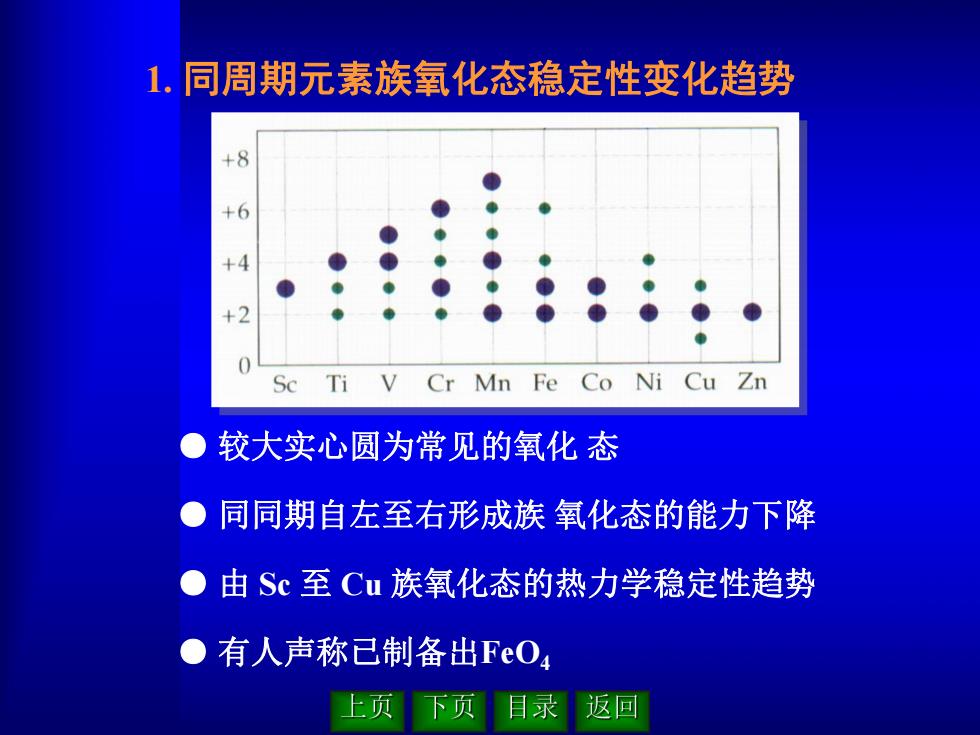
● 较大实心圆为常见的氧化 态 ● 同同期自左至右形成族 氧化态的能力下降 ● 由 Sc 至 Cu 族氧化态的热力学稳定性趋势 ● 有人声称已制备出FeO4 1. 同周期元素族氧化态稳定性变化趋势
● 较大实心圆为常见的氧化 态 ● 同同期自左至右形成族 氧化态的能力下降 ● 由 Sc 至 Cu 族氧化态的热力学稳定性趋势 ● 有人声称已制备出FeO4 1. 同周期元素族氧化态稳定性变化趋势

d 区金属自左至右族氧化态稳定性下降和低氧 化态稳定上升的趋势可以理解为核电荷逐渐增加, 对价层电子控制能力逐渐加大的结果。 2.同周期元素低氧化态(+2氧化态)稳定性变化趋势 d 电子组态 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 M2+(aq) Sc 2+ Ti2+ V2+ Cr 2+ Mn2+ Fe 2+ Co2+ Ni2+ Cu2+ Zn2+ 稳 定 性 增 大 2 V2+(aq) + 2 H3O+(aq) 2V3+(aq) + H2(g) + 2 H2O(l) 2 Cr 2+(aq) + 2 H3O+(aq) 2 Cr 3+(aq) + H2(g) + 2 H2O(l) Mn2+(aq) Ni和Cu(当然还有Zn)的稳定水合离子只能是二价的
d 区金属自左至右族氧化态稳定性下降和低氧 化态稳定上升的趋势可以理解为核电荷逐渐增加, 对价层电子控制能力逐渐加大的结果。 2.同周期元素低氧化态(+2氧化态)稳定性变化趋势 d 电子组态 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 M2+(aq) Sc 2+ Ti2+ V2+ Cr 2+ Mn2+ Fe 2+ Co2+ Ni2+ Cu2+ Zn2+ 稳 定 性 增 大 2 V2+(aq) + 2 H3O+(aq) 2V3+(aq) + H2(g) + 2 H2O(l) 2 Cr 2+(aq) + 2 H3O+(aq) 2 Cr 3+(aq) + H2(g) + 2 H2O(l) Mn2+(aq) Ni和Cu(当然还有Zn)的稳定水合离子只能是二价的