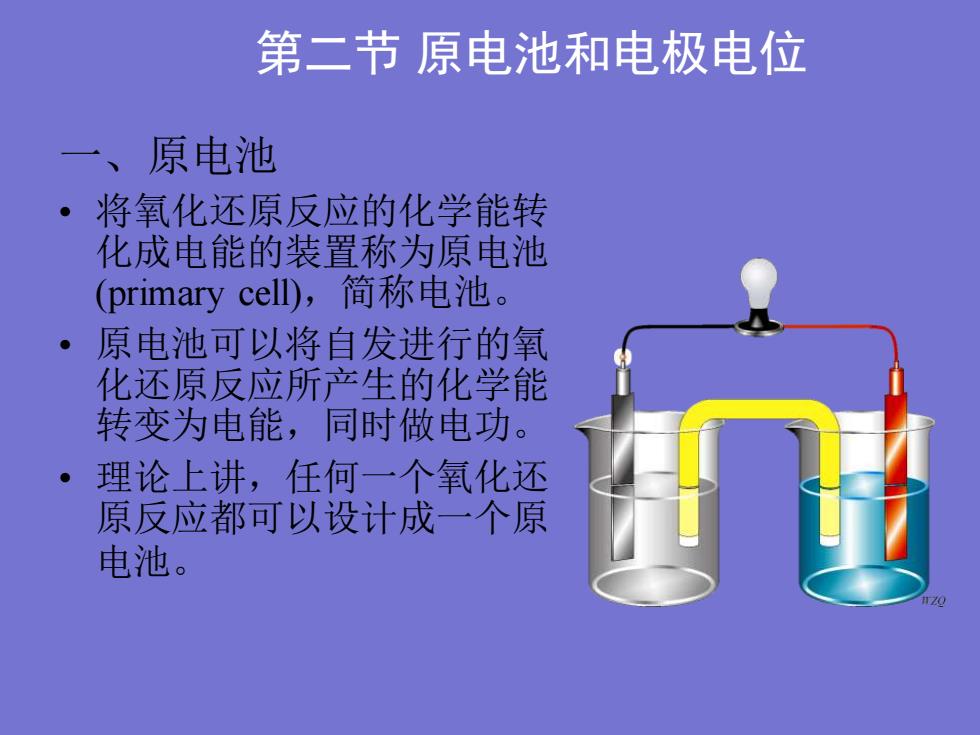
第二节原电池和电极电位一、原电池·将氧化还原反应的化学能转化成电能的装置称为原电池(primarycell),简称电池原电池可以将自发进行的氧化还原反应所产生的化学能转变为电能,同时做电功。理论上讲,任何一个氧化还原反应都可以设计成一个原电池。170
第二节 原电池和电极电位 一、原电池 • 将氧化还原反应的化学能转 化成电能的装置称为原电池 (primary cell),简称电池。 • 原电池可以将自发进行的氧 化还原反应所产生的化学能 转变为电能,同时做电功。 • 理论上讲,任何一个氧化还 原反应都可以设计成一个原 电池
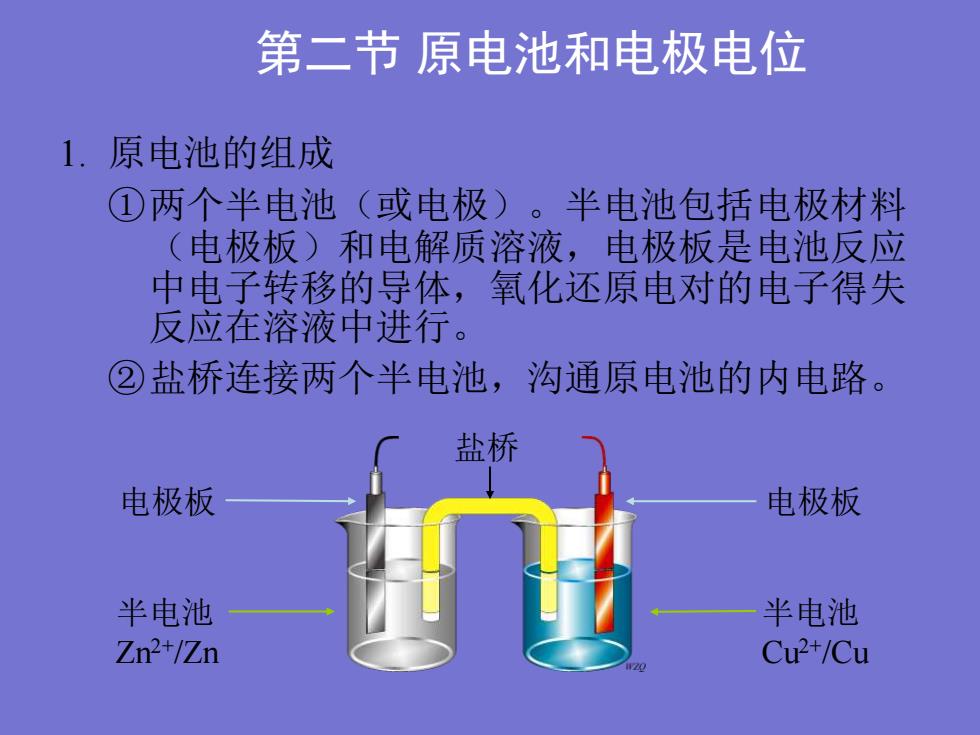
第二节原电池和电极电位1.原电池的组成①两个半电池(或电极)。半电池包括电极材料(电极板)和电解质溶液,电极板是电池反应中电子转移的导体,氧化还原电对的电子得失反应在溶液中进行。②盐桥连接两个半电池,沟通原电池的内电路盐桥电极板电极板半电池半电池Zn2+/ZnCu2+/Cu
第二节 原电池和电极电位 1. 原电池的组成 ①两个半电池(或电极)。半电池包括电极材料 (电极板)和电解质溶液,电极板是电池反应 中电子转移的导体,氧化还原电对的电子得失 反应在溶液中进行。 ②盐桥连接两个半电池,沟通原电池的内电路。 半电池 Zn2+/Zn 半电池 Cu2+/Cu 电极板 电极板 盐桥

第二节原电池和电极电位2.电池的反应将ZnSO溶液和Zn片构成Zn半电池,是原电池的负极(anode);CuSO,溶液和Cu片构成Cu半电池,是原电池的正极(cathode)。负极反应Zn → Zn2+ + 2e'(氧化反应)正极反应(还原反应)Cu2++2e→Cu由正极反应和负极反应所构成的总反应,称为电池反应(cellreaction)。Zn + Cu2+Cu+Zn2+
第二节 原电池和电极电位 2. 电池的反应 将ZnSO4 溶液和Zn片构成Zn半电池,是原电 池的负极(anode); CuSO4溶液和Cu片构成Cu 半电池,是原电池的正极(cathode)。 • 负极反应 Zn → Zn2+ + 2e- (氧化反应) • 正极反应 Cu2+ + 2e- → Cu (还原反应) 由正极反应和负极反应所构成的总反应,称 为电池反应(cell reaction)。 Zn + Cu2+ Cu + Zn2+

第二节原电池和电极电位3.原电池组成式“"表示相界面,同一相的不同物质用“"隔开。“"表示盐桥。溶质标浓度:气体标压力。溶液靠盐桥,电极板在两边。ZO负极在左,正极在()Zn/Zn2+(c)JlCu2+(c)/Cu(+)
第二节 原电池和电极电位 3. 原电池组成式 ① “|”表示相界面,同一相 的不同物质用“,”隔开。 ② “||”表示盐桥。 ③ 溶质标浓度;气体标压 力。 ④ 溶液靠盐桥,电极板在 两边。 ⑤ 负极在左,正极在。 (-) Zn | Zn2+ (c1 ) || Cu2+ (c2 ) | Cu (+)