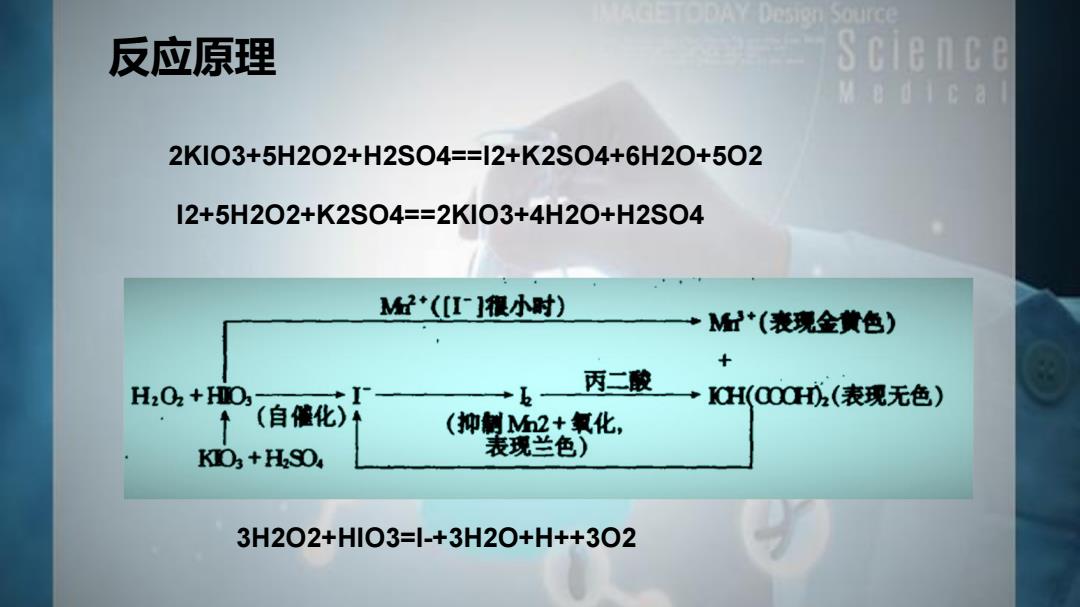
反应原理 Science M e d 1 c a l 2KIO3+5H202+H2S04==12+K2S04+6H20+502 I2+5H202+K2S04==2KIO3+4H20+H2SO4 MH*([I]很小时) +M*(表现金黄色) + H2O2+HO; 丙二酸→CH(000(表现无色) ↑ (自催化) (抑制M2+氧化, KIO+HSO 表现兰色) 3H2O2+HIO3=|-+3H2O+H++3O2
3H2O2+HIO3=I-+3H2O+H++3O2 2KIO3+5H2O2+H2SO4==I2+K2SO4+6H2O+5O2 I2+5H2O2+K2SO4==2KIO3+4H2O+H2SO4 反应原理

反应原理 Science M e d 1 c al 当足够多时,将口3成游离碘。游离碘的 生成,一方面抑制了Mn2+的氧化,使l2得到积 累,表观现象是溶液呈蓝色; I2与丙二酸作用生成ICH(COOH)2,消耗了游 离碘,恢复无色,同时生成了小 产物固定 H202消耗 反应循环 有自催化作用的HIO2浓度增加,有利于将 反应停止 Mn2+氧化为Mn3+溶液表观现象由无色变为 金黄色 Mn3+在与ICH(COOH)2,反应,生成,同时将 Mn3+还原为Mn2+
当I -足够多时,I -将IO3 -成游离碘。游离碘的 生成,一方面抑制了Mn2+的氧化,使I2得到积 累,表观现象是溶液呈蓝色; I2与丙二酸作用生成ICH(COOH)2 ,消耗了游 离碘,恢复无色,同时生成了I - Mn3+在与ICH(COOH)2 ,反应,生成I -,同时将 Mn3+还原为Mn2+ 有自催化作用的HIO2浓度增加,有利于将 Mn2+氧化为Mn3+溶液表观现象由无色变为 金黄色 反应原理

ADAY Design Source 实验过程 Science M e d 1 c a l
实验过程
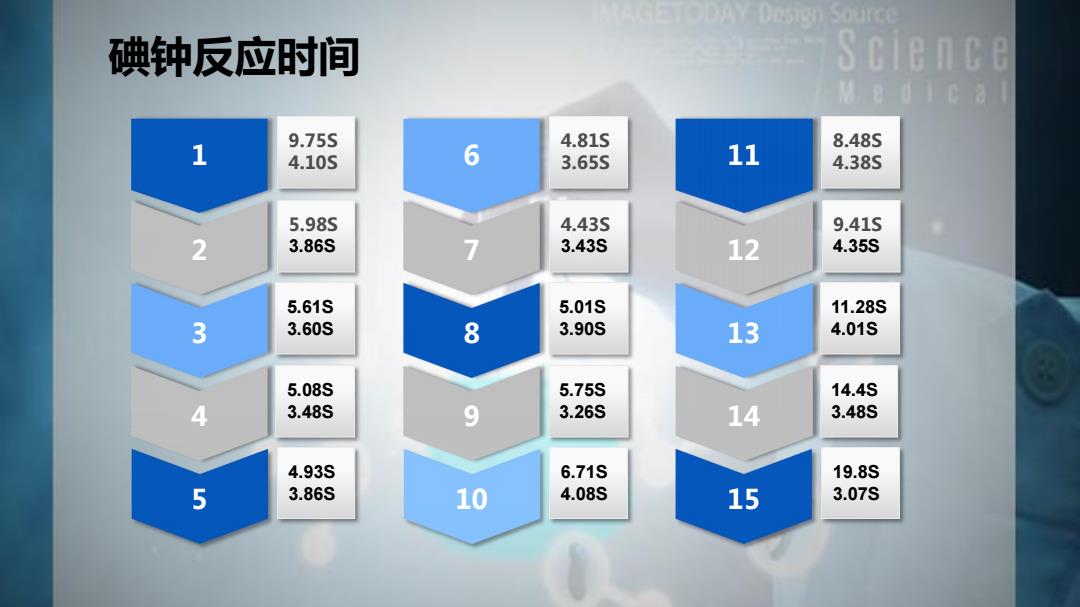
碘钟反应时间 Science M e d i c a l 1 9.75s 4.81s 4.10s 6 3.655 11 8.48s 4.38s 5.98s 4.435 9.41s 2 3.86s 7 3.43s 12 4.35S 5.61S 5.01S 11.28S 3 3.60S 8 3.90s 13 4.01S 5.08S 5.75S 14.4S 4 3.48S 9 3.26S 14 3.48S 4.93S 6.71S 19.8S 5 3.86S 10 4.08S 15 3.07S
9.75S 1 4.10S 5.98S 2 3.86S 5.61S 3 3.60S 5.08S 4 3.48S 4.93S 3.86S 5 碘钟反应时间 4.81S 6 3.65S 4.43S 7 3.43S 5.01S 8 3.90S 5.75S 9 3.26S 6.71S 4.08S 10 8.48S 11 4.38S 9.41S 12 4.35S 11.28S 13 4.01S 14.4S 14 3.48S 19.8S 3.07S 15

AEDAY Desion Source 实验记录 Science 80g8I
实验记录