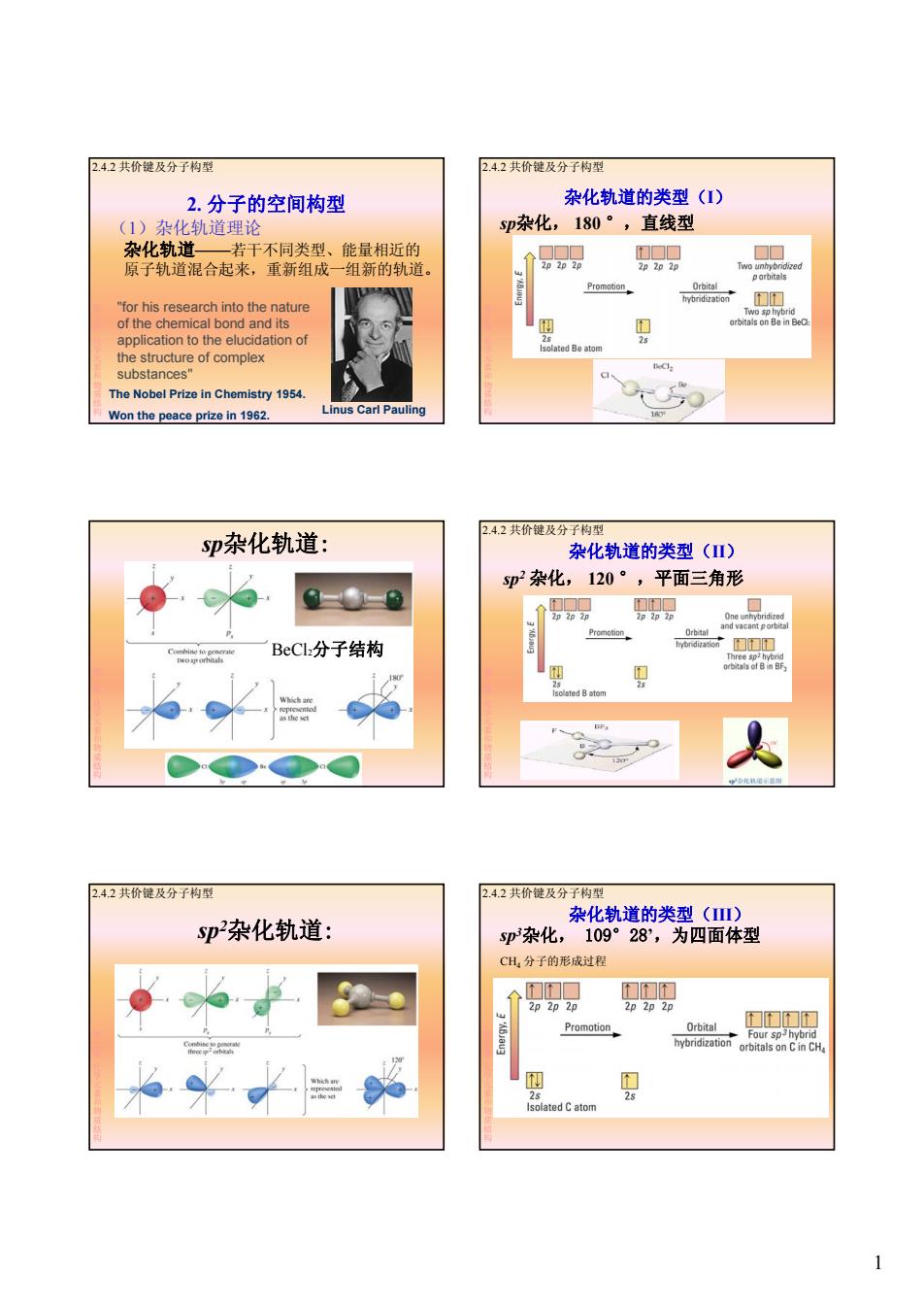
2.4.2共价键及分子构型 2.4.2共价键及分子构型 2.分子的空间构型 杂化轨道的类型(I) (1)杂化轨道理论 sp杂化,180°,直线型 杂化轨道一若干不同类型、 能量相近的 □□ 原子轨道混合起来,重新组成一组新的轨道。 2p2p 2p 2p 2p2p Two unhy Promotion Orbital "for his research into the nature 门 Two sp hybrid of the chemical bond and its orbitals on Be in BeC application to the elucidation of 25 Isolated Be atom the structure of complex substances" The Nobel Prize in Chemistry 1954. Won the peace prize in 1962. Linus Carl Pauling 180 2.4.2共价键及分子构型 Sp杂化轨道: 杂化轨道的类型(Ⅲ) Sp2杂化,120°,平面三角形 面图圆 2p2p2p 2p2p 2p Promotion and vacant pon由ta Orb tal BeCl分子结构 16m3 bridization下TT 县 itBi时, Isolated B atom nF. F 。化道用 2.4.2共价键及分子构型 2.4.2共价键及分子构型 杂化轨道的类型(Ⅲ) Sp杂化轨道: sp杂化,109°28',为四面体型 CH,分子的形成过程 和们口 们们和 2p 2p 2p 2p 2p 2p M们 61a0g Promotion Orbital hybridization Four sp3hybrid orbitals on C in CHa 四 2s 25 Isolated C atom
1 2. 分子的空间构型 (1)杂化轨道理论 杂化轨道——若干不同类型、能量相近的 原子轨道混合起来,重新组成一组新的轨道。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 "for his research into the nature of the chemical bond and its application to the elucidation of the structure of complex substances" Linus Carl Pauling The Nobel Prize in Chemistry 1954. Won the peace prize in 1962. 杂化轨道的类型(I) sp杂化, 180 °,直线型 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp杂化轨道: BeCl2分子结构 第 2章化学元素和物质结构 BeCl2分子结构 sp2 杂化, 120 °,平面三角形 2.4.2 共价键及分子构型 杂化轨道的类型(II) 第 2章化学元素和物质结构 sp2杂化轨道: 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp3杂化, 109°28’,为四面体型 CH4 分子的形成过程 2.4.2 共价键及分子构型 杂化轨道的类型(III) 第 2章化学元素和物质结构
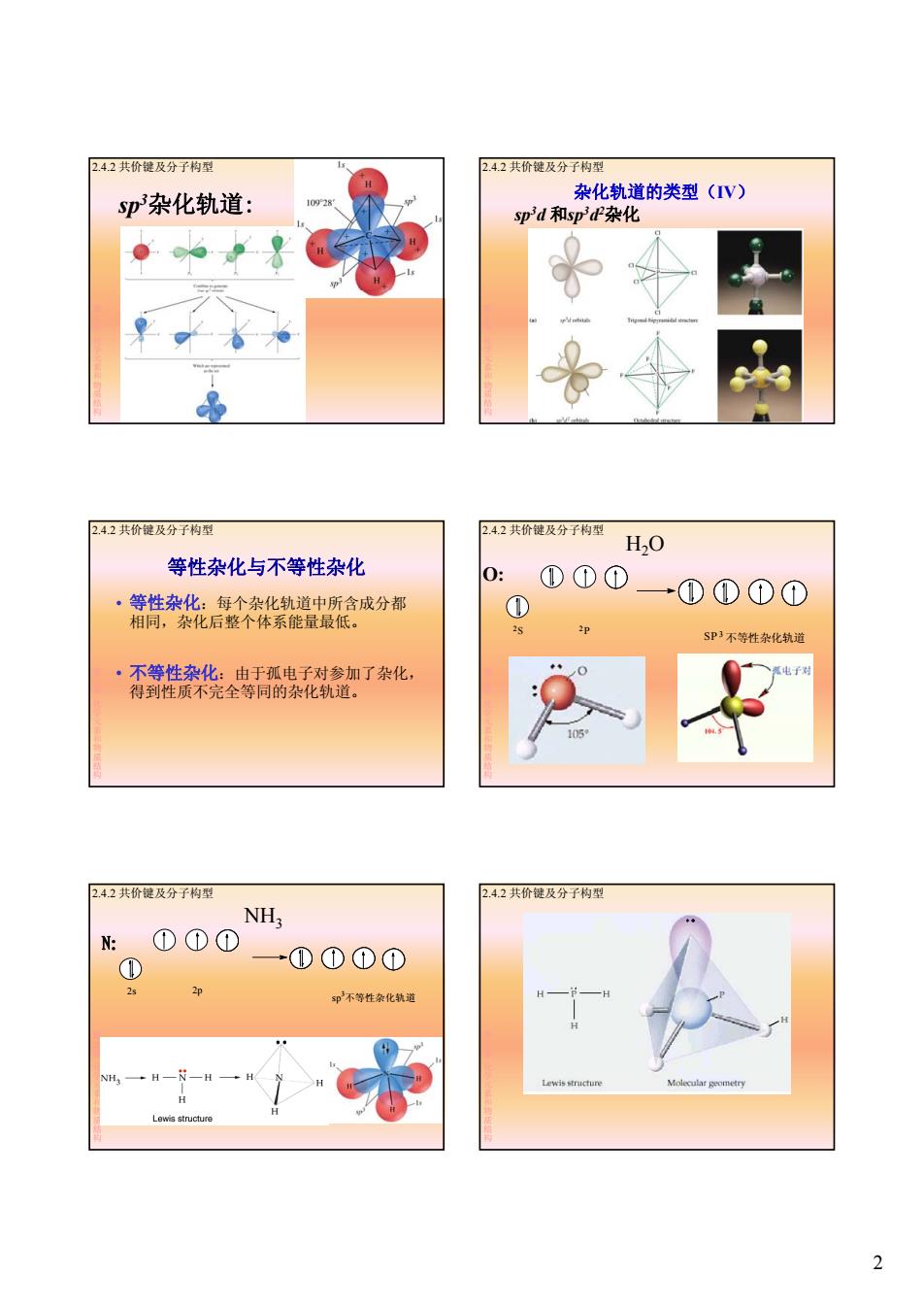
2.4.2共价键及分子构型 2.4.2共价键及分子构型 sp杂化轨道: 杂化轨道的类型(IV) sp3d和spP杂化 2.4.2共价键及分子构型 2.4.2共价键及分子构型 HO 等性杂化与不等性杂化 0: ①①① 。等性杂化:每个杂化轨道中所含成分都 ① ①①①① 相同,杂化后整个体系能量最低。 SP3不等性杂化轨道 ·不等性杂化:由于孤电子对参加了杂化, 弧电子对 得到性质不完全等同的杂化轨道。 105* 2.4.2共价键及分子构型 2.4.2共价键及分子构型 NHg : ①①① ① →①①①① 2 2p 印不等性杂化轨道 Lewis structure Lewis structure 2
2 sp3杂化轨道: 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 sp3d 和sp3d2杂化 2.4.2 共价键及分子构型 杂化轨道的类型(IV) 第 2章化学元素和物质结构 等性杂化与不等性杂化 • 等性杂化:每个杂化轨道中所含成分都 相同,杂化后整个体系能量最低。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 • 不等性杂化:由于孤电子对参加了杂化, 得到性质不完全等同的杂化轨道。 H2O O: S P 2 2 SP 3 不等性杂化轨道 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 NH3 N: 2s 2p sp3 不等性杂化轨道 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 2.4.2 共价键及分子构型 第 2章化学元素和物质结构
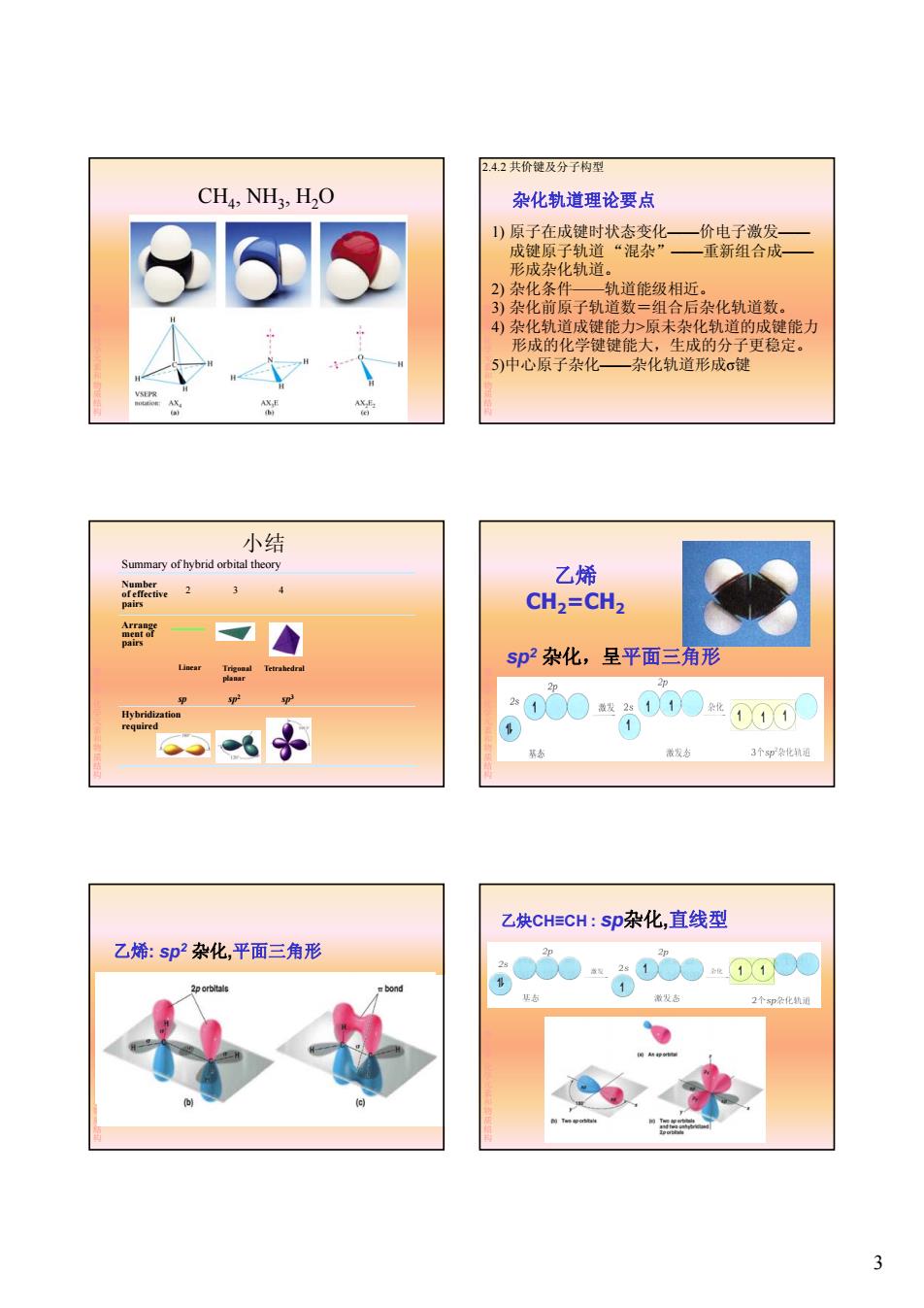
2.4.2共价键及分子构型 CHA NH?,H2O 杂化轨道理论要点 1)原子在成键时状态变化一价电子激发一 成键原子轨道“混杂”一重新组合成一 形成杂化轨道。 2)杂化条件一轨道能级相近。 3)杂化前原子轨道数=组合后杂化轨道数。 4)杂化轨道成键能力>原未杂化轨道的成键能力 形成的化学键键能大,生成的分子更稳定。 5)中心原子杂化一杂化轨道形成σ键 VSEPR 小结 Summary ofhybrid orbital theory Number 乙烯 of effective 2 4 pairs CH2=CH2 7 sp2杂化,呈平面三角形 sp Hybridization required 徽发态 3个5即袋化轨通 乙炔CHECH:Sp杂化,直线型 乙烯:sp2杂化,平面三角形 00o0●00●0 bond 1 激发态 2个郑条化轨通 3
3 CH4, NH3, H2O 第 2章化学元素和物质结构 杂化轨道理论要点 1) 原子在成键时状态变化——价电子激发—— 成键原子轨道 “混杂”——重新组合成—— 形成杂化轨道。 2) 杂化条件——轨道能级相近。 2.4.2 共价键及分子构型 第 2章化学元素和物质结构 2) 杂化条件 轨道能级相近。 3) 杂化前原子轨道数=组合后杂化轨道数。 4) 杂化轨道成键能力>原未杂化轨道的成键能力 形成的化学键键能大,生成的分子更稳定。 5)中心原子杂化——杂化轨道形成σ键 Number of effective pairs Arrange ment of pairs 2 3 4 Summary of hybrid orbital theory 小结 第 2章化学元素和物质结构 Hybridization required Linear sp Trigonal planar sp2 Tetrahedral sp3 乙烯 CH2=CH2 第 sp2 杂化 呈平面三角形 2章化学元素和物质结构 sp2 杂化,呈平面三角形 乙烯: sp2 杂化,平面三角形 第 2章化学元素和物质结构 乙炔CH≡CH : sp杂化,直线型 第 2章化学元素和物质结构
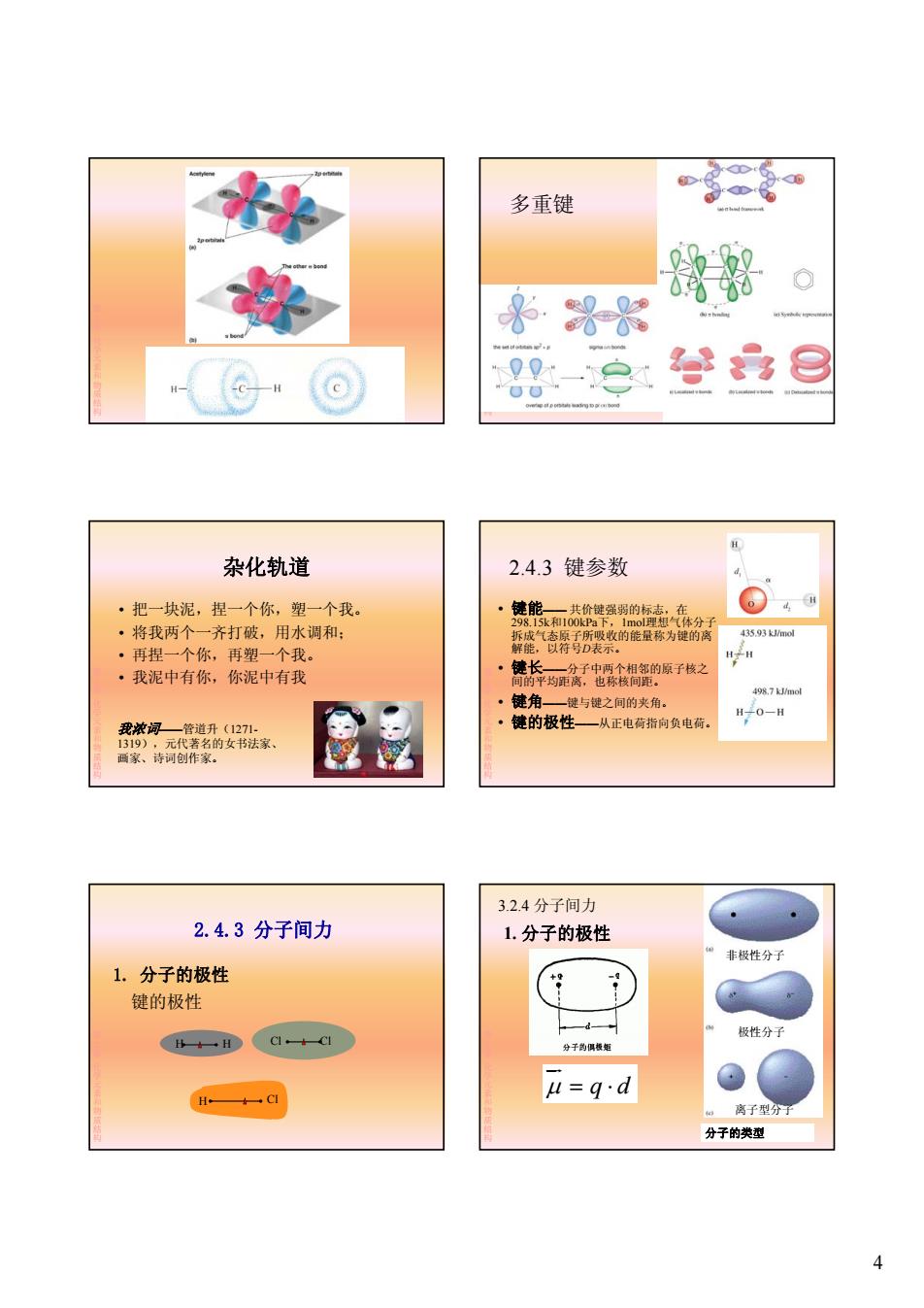
多重键 混帮 ·界 009 ee H 杂化轨道 2.4.3键参数 d ·把一块泥,捏一个你,塑一个我。 键能一共价键强弱的标志,在 4 298.15k和100kPa下,1mol理想气体分子 ·将我两个一齐打破,用水调和: 435.93 kJ/mol ·再捏一个你,再塑一个我。 能查聚的能量称为的 。 键长一分子中两个相邻的原子核之 时H ·我泥中有你,你泥中有我 间的平均距离,也称核间距。 498.7J/mol 键角一键与键之间的夹角。 。 键的极性一从正电荷指向负电荷。 H.O-H 我浓词一管道升(1271. 1319),元代著名的女书法家、 画家、诗词创作家。 3.2.4分子间力 2.4.3分子间力 1.分子的极性 非极性分子 1.分子的极性 键的极性 d 极性分子 B+一H C1·+C1 分子的俱板矩 上H 女C l=q·d 离子型分 分子的类型 4
4 第 2章化学元素和物质结构 多重键 第 2章化学元素和物质结构 杂化轨道 • 把一块泥,捏一个你,塑一个我。 • 将我两个一齐打破,用水调和; 第 • 再捏一个你 再塑一个我 2章化学元素和物质结构 • 再捏一个你,再塑一个我。 • 我泥中有你,你泥中有我 我浓词——管道升(1271- 1319),元代著名的女书法家、 画家、诗词创作家。 2.4.3 键参数 • 键能—— 共价键强弱的标志,在 298.15k和100kPa下,1mol理想气体分子 拆成气态原子所吸收的能量称为键的离 解能,以符号D表示。 第 2章化学元素和物质结构 • 键长——分子中两个相邻的原子核之 间的平均距离,也称核间距。 • 键角——键与键之间的夹角。 • 键的极性——从正电荷指向负电荷。 2.4.3 分子间力 1. 分子的极性 键的极性 第 2章化学元素和物质结构 H Cl H H Cl Cl 3.2.4 分子间力 1. 分子的极性 非极性分子 第 2章化学元素和物质结构 q d 分子的类型 极性分子 离子型分子
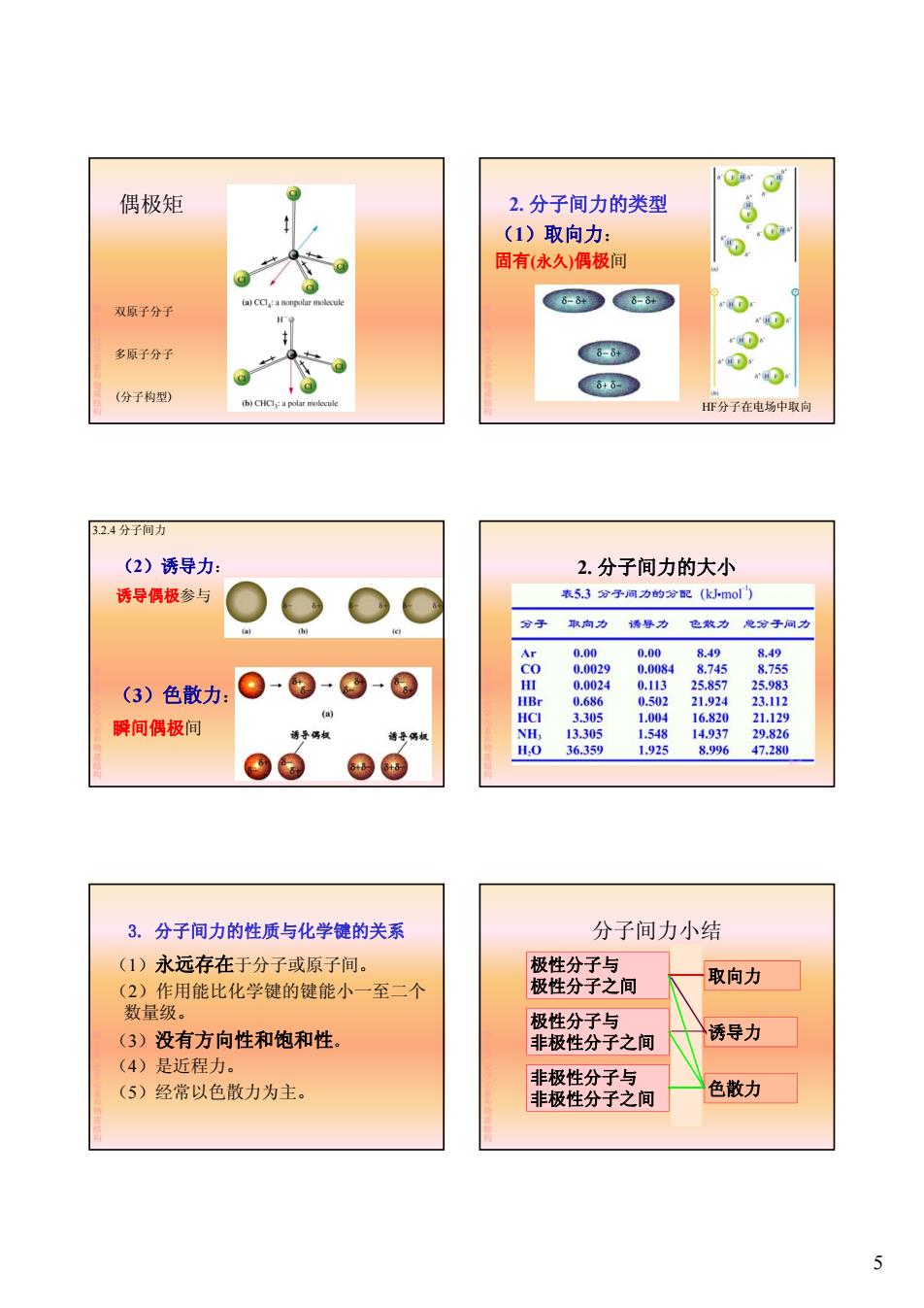
偶极矩 2.分子间力的类型 (1)取向力: 固有(永久)偶极间 双原子分子 多原子分子 8+ (分子构型) (b)CHCl:a polar molecule HF分子在电场中取向 3.2.4分子间力 (2)诱导力: 2.分子间力的大小 诱导偶极参与 表53分子间力的分配(km0l) 分子 取向力 诱绿力 色收力 地分子间力 Ar 0.00 0.00 8.49 8.49 co 0.0029 0.0084 8.745 8.755 (3)色散力: H 0.0024 0.113 25.857 25.983 HBr 0.686 0.502 21.924 23.112 3.305 1.004 瞬间偶极间 HCI 16.820 21.129 NH, 13.305 1.548 14.937 29.826 H.O 36.359 1.925 8.996 47.280 3.分子间力的性质与化学键的关系 分子间力小结 (1)永远存在于分子或原子间。 极性分子与 取向力 (2)作用能比化学键的键能小一至二个 极性分子之间 数量级。 极性分子与 (3)没有方向性和饱和性。 非极性分子之间 诱导力 (4)是近程力。 非极性分子与 (5)经常以色散力为主。 非极性分子之间 色散力 5
5 偶极矩 第 2章化学元素和物质结构 双原子分子 多原子分子 (分子构型) 2. 分子间力的类型 (1)取向力: 固有(永久)偶极间 第 2章化学元素和物质结构 HF分子在电场中取向 (2)诱导力: 诱导偶极参与 3.2.4 分子间力 第 2章化学元素和物质结构 (3)色散力: 瞬间偶极间 2. 分子间力的大小 第 2章化学元素和物质结构 3. 分子间力的性质与化学键的关系 (1)永远存在于分子或原子间。 (2)作用能比化学键的键能小一至二个 数量级。 第 2章化学元素和物质结构 数量级。 (3)没有方向性和饱和性。 (4)是近程力。 (5)经常以色散力为主。 分子间力小结 极性分子与 极性分子之间 极性分子与 取向力 第 2章化学元素和物质结构 极性分子与 非极性分子之间 非极性分子与 非极性分子之间 诱导力 色散力