
2:=[c(Ab+)]a[c(Ba-)]b 2,表达式中的c(A+)和 c(Ba)不是平衡浓度
Qi 表达式中的 c Ab+ 和 c Ba ( +)不是平衡浓度。 ( ) Qi = [c Ab+ ] a [c Ba– ] ( ) ( )b

AgCI Ag+CI 2:>Kp时,平衡左移,将生成沉淀 O:<Kp时,平衡右移,沉淀将溶解 O:=Kp时,达到沉淀溶解平衡 上述结论有时称之为溶度积原理
Qi > Ksp 时,平衡左移,将生成沉淀 上述结论有时称之为溶度积原理。 Qi < Ksp 时,平衡右移,沉淀将溶解 Qi = Ksp 时,达到沉淀溶解平衡 AgCl Ag+ + Cl-
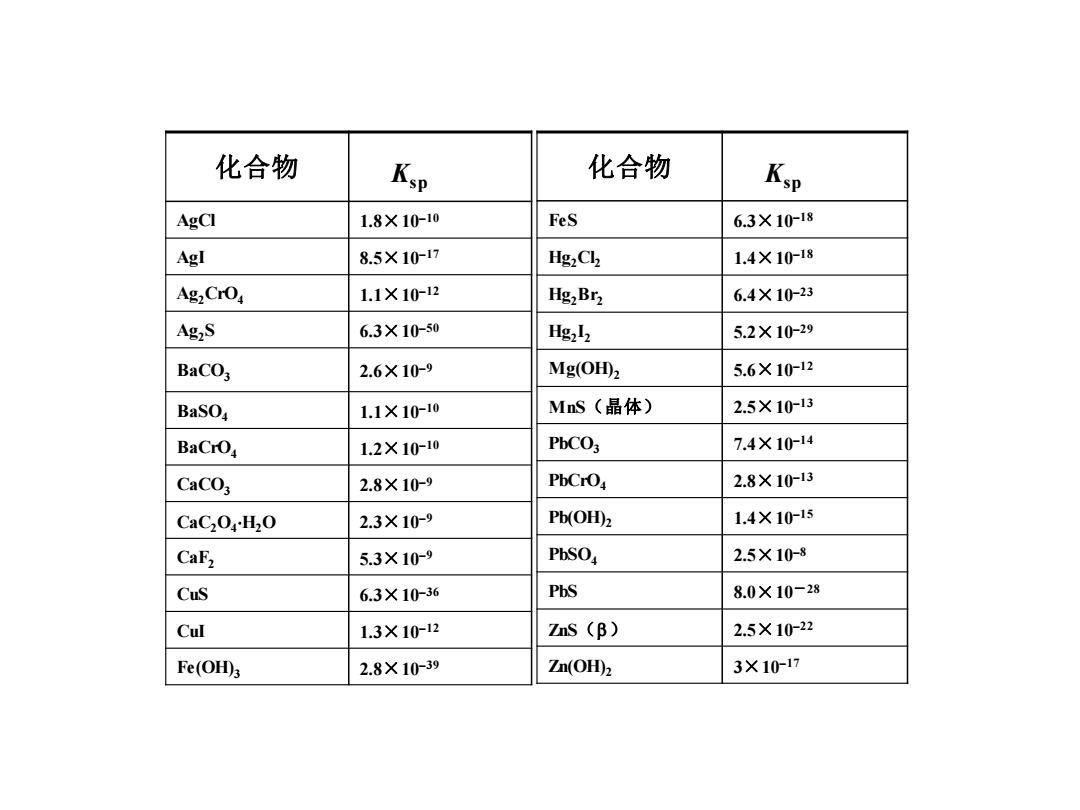
化合物 Ksp 化合物 Ksp AgCI 1.8×10-10 FeS 6.3×1018 AgI 8.5×1017 Hg2Ch 1.4×10-18 Ag,CrO 1.1×10-12 Hg,Br2 6.4×10-23 AgS 6.3X10-50 Hg212 5.2×10-29 BaCO3 2.6X10-9 Mg(OH) 5.6×10-12 BaSO4 1.1×1010 MnS(晶体) 2.5×1013 BaCrOa 1.2×1010 PbCO3 7.4×10-14 CaCO3 2.8×109 PbCrO4 2.8×1013 CaC2OH2O 2.3×109 Pb(OH)2 1.4×10-15 CaFz 5.3×10-9 PbSO, 2.5×10-8 CuS 6.3×10-36 PbS 8.0×10-28 Cul 1.3×10-12 ZnS (B) 2.5×10-22 Fe(OH田3 2.8×1039 Zn(OH)2 3×1017
化合物 Ksp AgCl 1.8×10–10 AgI 8.5×10–17 Ag2CrO4 1.1×10–12 Ag2S 6.3×10–50 BaCO3 2.6×10–9 BaSO4 1.1×10–10 BaCrO4 1.2×10–10 CaCO3 2.8×10–9 CaC2O4 H2O 2.3×10–9 CaF2 5.3×10–9 CuS 6.3×10–36 CuI 1.3×10–12 Fe(OH)3 2.8×10–39 化合物 Ksp FeS 6.3×10–18 Hg2Cl2 1.4×10–18 Hg2Br2 6.4×10–23 Hg2 I2 5.2×10–29 Mg(OH)2 5.6×10–12 MnS(晶体) 2.5×10–13 PbCO3 7.4×10–14 PbCrO4 2.8×10–13 Pb(OH)2 1.4×10–15 PbSO4 2.5×10–8 PbS 8.0×10-28 ZnS() 2.5×10–22 Zn(OH)2 3×10–17

9.1.3盐效应对溶解度的影响 根据溶度积原理,当2:>Ksp 时,将生成沉淀。 但是在配制溶液和进行化学反 应的过程中,有时2>Kp’却没 有观察到沉淀物的生成
9. 1. 3 盐效应对溶解度的影响 根据溶度积原理,当 Qi > Ksp 时,将生成沉淀。 但是在配制溶液和进行化学反 应的过程中,有时 Qi > Ksp,却没 有观察到沉淀物的生成

例如AgCI→Ag*+ CI 当c(Ag)c(CI-)略大于Ksp’ 即2略大于Kp时, 其活度积a(Ag)a(CI-)可能 还小于Ks即,故不能生成沉淀,当然 观察不到
当 c Ag+ c Cl- 略大于 Ksp, 即 Qi 略大于 Ksp 时, ( )( ) 例如 AgCl Ag+ + Cl- 其活度积 a Ag+ a Cl- 可能 还小于 Ksp,故不能生成沉淀,当然 观察不到。 ( )( )