
式中c一由标准曲线上查得的蛋白质质量,mg 样品质量,g 5.说明及注意事项 ①蛋白质的种类不同,对发色程度影响不大。②标准曲线制作完整后,无需每次再作标 准曲线。③含脂肪高的样品应预先用醚抽出弃去。④样品中有不溶性成分存在时,会给比色 测定带来困难,此时可预先将蛋白质抽出后再进行测定。⑤当肚链中含有肺氨酸时,若有多 量糖类共存,则显色不好,会使测定值偏低。⑥碱性硫酸钢溶液由0.1mol氢氧化钾、5g酒 石酸钾钠、1.6g硫酸铜溶于水后加水至1000mL配成。 三、紫外吸收法 1.A0nm光吸收法 (1)盾迎 白质浓度(3一8mg/mL)成直线关系,因此,通过测定蛋白质溶液的吸光度,并参照事 先用凯氏定氨法测定蛋白质含量的标准样所作的标准曲线,即可求出样品蛋白质含量。 (2)适用范围 本法操作简便迅速,常用于生物化学研究工作 但由干年多非蛋白质成分在紫外风 也有吸收作用, 加之光散射作用的干扰,故在食品分析领域中的应用并不广泛 ,最早用于测 定牛乳的蛋白质含量,也可用于测定小麦面粉、糕点、豆类、蛋黄及肉制品中的蛋白质含量。 (3)操作方法 ①标准曲线绘制:准确称取样品2.00g,置于50mL烧杯中,加入0.1molL柠檬酸溶液 30mL,不断搅拌10min使其充分溶解,用四层纱布过滤于玻璃离心管中,以3000~5000rmim 的速度离心5 出上清液。分别吸取0.5、 2.5、3.0mL于10mL容 量瓶中,各加入8molL尿素的氢氧化钠溶液定容至标线,充分振摇2min,若浑浊,再次 心直至透明为止。将透明液置于比色皿中,以8molL尿素的氢氧化钠溶液作参比液,在 280nm波长处测定各溶液的吸光度A. 以事先用凯氏定氮法测得的样品中蛋白质的质量为横坐标,上述吸光度A为纵坐标, 绘制标准曲线。 ②样品的测 :准确称取试样1.00g,如前处理,吸取的每毫升样品溶液中含有大约3 8g的蛋白质。按标准曲线绘制的架作条件测定其吸光度,从标准曲线中查出蛋白质的含量。 (4)结果计算 蛋白质质量分数(%)=≤x1C 式中:c一 一从标准曲线上查得的 白质质最 mg: -测定样品溶液所相当于样品的质量,mg。 (7)说明及注意事项 ①测定牛乳样品时的操作手续:准确吸取混合均匀的样品0.2mL于25mL纳氏比色管中, 用95%97%的冰错酸稀释至标线,摇匀,以95%~一97%冰酷酸为参比液,用1cm比色皿 于280nm处测定吸光度, 并用标准曲线法确定样品蛋白质含量(标准曲线以采用凯氏定氮 法已测出蛋白质含最的牛乳标准样绘制) ②测定糕点时,应将表皮的颜色去掉。 ③温度对蛋白质水解有影响,操作温度应控制在20一30℃
式中 c——由标准曲线上查得的蛋白质质量,mg; m——样品质量,g。 5.说明及注意事项 ①蛋白质的种类不同,对发色程度影响不大。②标准曲线制作完整后,无需每次再作标 准曲线。③含脂肪高的样品应预先用醚抽出弃去。④样品中有不溶性成分存在时,会给比色 测定带来困难,此时可预先将蛋白质抽出后再进行测定。⑤当肽链中含有脯氨酸时,若有多 量糖类共存,则显色不好,会使测定值偏低。⑥碱性硫酸铜溶液由 0.1mol 氢氧化钾、5g 酒 石酸钾钠、1.6g 硫酸铜溶于水后加水至 1000mL 配成。 三、紫外吸收法 1.A280nm 光吸收法 (1)原理 蛋白质及其降解产物(“月示”、胨、肽和氨基酸)的芳香环残基[-NH-CH(R)-CO-] 在紫外区内对一定波长的光具有选择吸收作用。在此波长(280mm)下,光吸收程度与蛋 白质浓度(3~8mg/mL)成直线关系,因此,通过测定蛋白质溶液的吸光度,并参照事 先用凯氏定氮法测定蛋白质含量的标准样所作的标准曲线,即可求出样品蛋白质含量。 (2)适用范围 本法操作简便迅速,常用于生物化学研究工作;但由于许多非蛋白质成分在紫外光区 也有吸收作用,加之光散射作用的干扰,故在食品分析领域中的应用并不广泛,最早用于测 定牛乳的蛋白质含量,也可用于测定小麦面粉、糕点、豆类、蛋黄及肉制品中的蛋白质含量。 (3)操作方法 ①标准曲线绘制:准确称取样品 2.00g,置于 50mL 烧杯中,加入 0.1mol/L 柠檬酸溶液 30mL,不断搅拌 10min 使其充分溶解,用四层纱布过滤于玻璃离心管中,以 3000~5000r/min 的速度离心 5~10min,倾出上清液。分别吸取 0.5、1.0、1.5、2.0、2.5、3.0mL 于 10mL 容 量瓶中,各加入 8mol/L 尿素的氢氧化钠溶液定容至标线,充分振摇 2min,若浑浊,再次离 心直至透明为止。将透明液置于比色皿中,以 8mol/L 尿素的氢氧化钠溶液作参比液,在 280nm 波长处测定各溶液的吸光度 A。 以事先用凯氏定氮法测得的样品中蛋白质的质量为横坐标,上述吸光度 A 为纵坐标, 绘制标准曲线。 ②样品的测定:准确称取试样 1.00g,如前处理,吸取的每毫升样品溶液中含有大约 3~ 8mg 的蛋白质。按标准曲线绘制的操作条件测定其吸光度,从标准曲线中查出蛋白质的含量。 (4)结果计算 蛋白质质量分数(%)= 式中:c——从标准曲线上查得的蛋白质质量,mg; m——测定样品溶液所相当于样品的质量,mg。 (7)说明及注意事项 ①测定牛乳样品时的操作手续:准确吸取混合均匀的样品0.2mL于25mL纳氏比色管中, 用 95%~97%的冰醋酸稀释至标线,摇匀,以 95%~97%冰醋酸为参比液,用 1cm 比色皿 于 280nm 处测定吸光度,并用标准曲线法确定样品蛋白质含量(标准曲线以采用凯氏定氮 法已测出蛋白质含量的牛乳标准样绘制)。 ②测定糕点时,应将表皮的颜色去掉。 ③温度对蛋白质水解有影响,操作温度应控制在 20~30℃
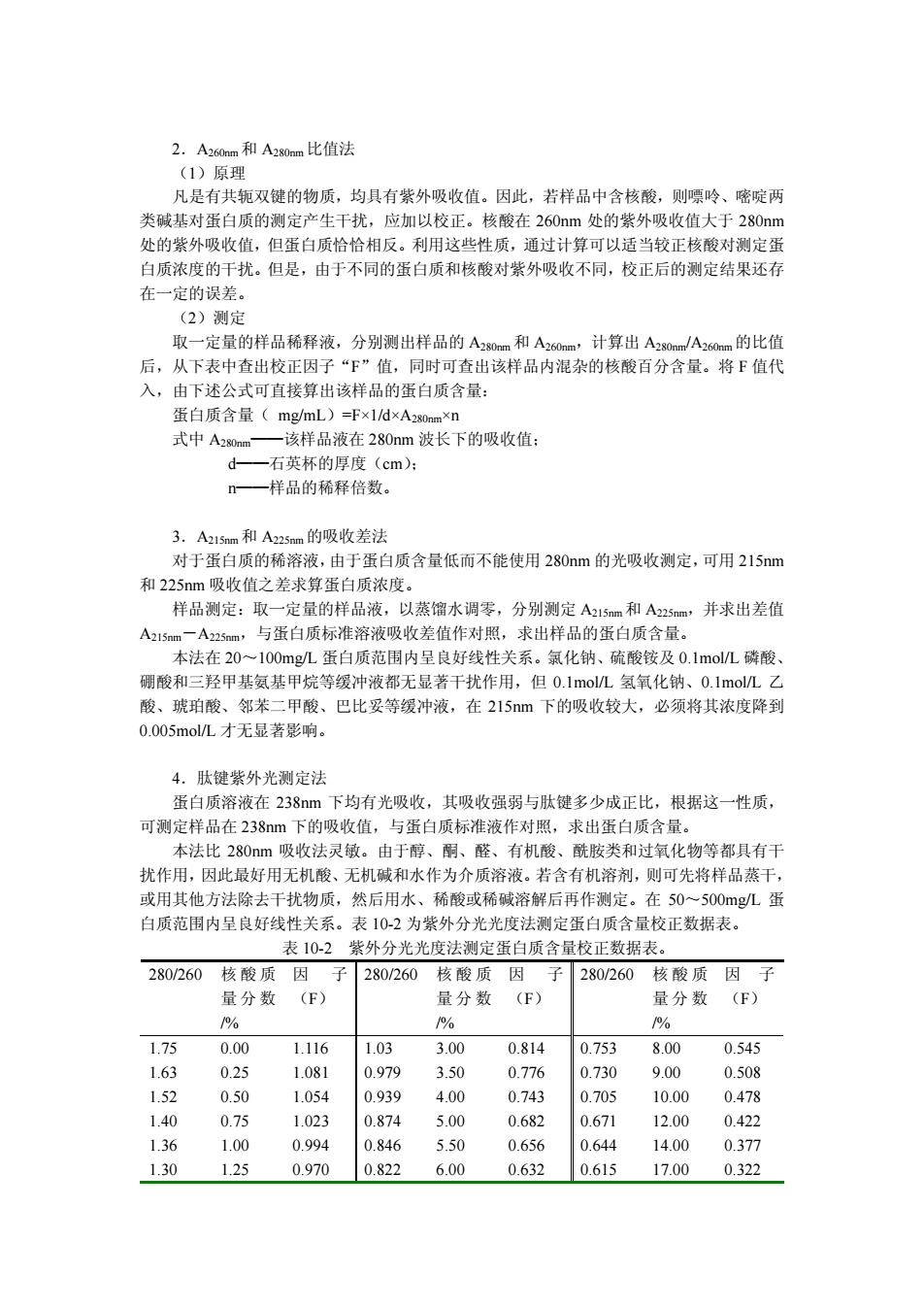
2.A60a和A2m比值法 (1)原理 凡是有共轭双的物质 ,均具有紫外吸收值。因此,若样品中含核酸,则嘌吟、嘧啶两 类碱基对蛋白质的测定产生干扰,应加以校正。核酸在260nm处的紫外吸收值大于280nm 处的紫外吸收值,但蛋白质恰恰相反。利用这些性质,通过计算可以适当较正核酸对测定蛋 白质浓度的干扰。但是,由于不同的蛋白质和核酸对紫外吸收不同,校正后的测定结果还存 在一定的误。 (2)测定 取一定量的样品稀释液,分别测出样品的A2nm和A260nm,计算出A2nmJA260m的比值 后,从下表中查出校正因子“下”值,同时可查出该样品内混杂的核酸百分含量。将F值代 入,由下述公式可直接算出该样品的蛋白质含量: 蛋白质含量(me/ml)=Fx1/ 式中A2 该样品液在280nm波长下的吸收值 d 石英杯的厚度(cm: 一样品的稀释倍数。 3.A1和Am的吸收差法 7226于蛋白质的稀溶波中于蛋白质含量低而不能使用280m的光吸收测定,可用2斗 m吸收值之差求算蛋白质浓度 样品测定:取一定量的样品液,以蒸馏水调零,分别测定A21s和A2s,并求出差值 A21s5m一A2sm,与蛋白质标准溶液吸收差值作对照,求出样品的蛋白质含量。 本法在20~100mgL蛋白质范围内呈良好线性关系。氯化钠、硫酸铵及0.1molL磷酸、 朋酸和三轻甲基氨基甲棕等缓冲液都无显芳千状作用,但01m0八.氨每化钠、01m0几,/ 酸、琥珀酸、 、巴比妥等缓冲液,在215m下的吸收较大,必须将其浓度降到 0.005molL才无显著影响。 4.肚键紫外光测定法 蛋白质溶液在238m下均有光吸收,其吸收强弱与肽键多少成正比,根据这一性质 可测定样品在238m下的吸收值,与蛋白质标准液作对照,求出蛋白质含量。 本法比280nm吸收法灵敏。由于 酮、醛、有机酸 酰胶类和过氧化物等都具有干 扰作用,因此最好用无机酸、无机碱和水作为介质溶液。若含有机溶剂,则可先将样品蒸干 或用其他方法除去干扰物质,然后用水、稀酸或稀碱溶解后再作测定。在50~500mgL蛋 白质范围内呈良好线性关系。表102为紫外分光光度法测定蛋白质含量校正数据表 表102紫外分光光度法测定蛋白质含量按正数据表。 280/260核酸质因 子280260核酸质因子280/260 核轂质 因子 量分数(F) 量分数(F) 量分数 (F) % % % 175 000 1116 103 300 0814 0753 800 0545 0.979 0.77 0.730 0.508 1.52 0.5 1.05 0.939 4.00 0.743 0.70 10.0 0.47 1.40 0.75 1023 0.87 5.00 0.682 0.671 1200 0.421 136 1.00 0994 0846 550 0656 0644 1400 0377 130 1.25 0.970 0.822 600 0.632 0.615 17.00 0.322
2.A260nm和 A280nm比值法 (1)原理 凡是有共轭双键的物质,均具有紫外吸收值。因此,若样品中含核酸,则嘌呤、嘧啶两 类碱基对蛋白质的测定产生干扰,应加以校正。核酸在 260nm 处的紫外吸收值大于 280nm 处的紫外吸收值,但蛋白质恰恰相反。利用这些性质,通过计算可以适当较正核酸对测定蛋 白质浓度的干扰。但是,由于不同的蛋白质和核酸对紫外吸收不同,校正后的测定结果还存 在一定的误差。 (2)测定 取一定量的样品稀释液,分别测出样品的 A280nm和 A260nm,计算出 A280nm/A260nm的比值 后,从下表中查出校正因子“F”值,同时可查出该样品内混杂的核酸百分含量。将 F 值代 入,由下述公式可直接算出该样品的蛋白质含量: 蛋白质含量( mg/mL)=F×1/d×A280nm×n 式中 A280nm——该样品液在 280nm 波长下的吸收值; d——石英杯的厚度(cm); n——样品的稀释倍数。 3.A215nm和 A225nm的吸收差法 对于蛋白质的稀溶液,由于蛋白质含量低而不能使用 280nm 的光吸收测定,可用 215nm 和 225nm 吸收值之差求算蛋白质浓度。 样品测定:取一定量的样品液,以蒸馏水调零,分别测定 A215nm和 A225nm,并求出差值 A215nm-A225nm,与蛋白质标准溶液吸收差值作对照,求出样品的蛋白质含量。 本法在 20~100mg/L 蛋白质范围内呈良好线性关系。氯化钠、硫酸铵及 0.1mol/L 磷酸、 硼酸和三羟甲基氨基甲烷等缓冲液都无显著干扰作用,但 0.1mol/L 氢氧化钠、0.1mol/L 乙 酸、琥珀酸、邻苯二甲酸、巴比妥等缓冲液,在 215nm 下的吸收较大,必须将其浓度降到 0.005mol/L 才无显著影响。 4.肽键紫外光测定法 蛋白质溶液在 238nm 下均有光吸收,其吸收强弱与肽键多少成正比,根据这一性质, 可测定样品在 238nm 下的吸收值,与蛋白质标准液作对照,求出蛋白质含量。 本法比 280nm 吸收法灵敏。由于醇、酮、醛、有机酸、酰胺类和过氧化物等都具有干 扰作用,因此最好用无机酸、无机碱和水作为介质溶液。若含有机溶剂,则可先将样品蒸干, 或用其他方法除去干扰物质,然后用水、稀酸或稀碱溶解后再作测定。在 50~500mg/L 蛋 白质范围内呈良好线性关系。表 10-2 为紫外分光光度法测定蛋白质含量校正数据表。 表 10-2 紫外分光光度法测定蛋白质含量校正数据表。 280/260 核酸质 量分数 /% 因 子 (F) 280/260 核酸质 量分数 /% 因 子 (F) 280/260 核酸质 量分数 /% 因 子 (F) 1.75 0.00 1.116 1.03 3.00 0.814 0.753 8.00 0.545 1.63 0.25 1.081 0.979 3.50 0.776 0.730 9.00 0.508 1.52 0.50 1.054 0.939 4.00 0.743 0.705 10.00 0.478 1.40 0.75 1.023 0.874 5.00 0.682 0.671 12.00 0.422 1.36 1.00 0.994 0.846 5.50 0.656 0.644 14.00 0.377 1.30 1.25 0.970 0.822 6.00 0.632 0.615 17.00 0.322

125 150 0944 0804 650 0607 0.595 20.00 0.278 1.16 200 089 07 0.58 1.00 2.50 0.852 0.767 7.50 0.565 注:表中的数值是由结品的酵母烯醇化酶和纯的酵母核酸的吸光度计算得来的。一般,纯蛋白质的吸 光度比值(280260)约为1.8,而核酸的比值大约为0.5。 四、福林-酚比色法 1.夏理 蛋白质与福林(下)酚试剂反应,产生蓝伍复合物。作用机理主要是蛋白质中的肚 健与碱性铜盐产生双缩脲反应,同时也由于蛋白质中存在 的酪氨酸与色氨酸同磷组酸磷鹤 酸试剂反应产生颜色。呈色强度与蛋白质含量成正比,是检测可溶性蛋白质含量最灵敏的经 典方法之 2.试剂 ①福林酚试剂甲:将溶液A50mL和溶液B1mL混合即成。现用现配,过期失效。 溶液A:1gNa,CO,溶于50mL0.1mol/LNaOH溶液中. 溶液B:将1%硫酸溶液和20gL酒石酸钠(钾)溶液等体积混合而成 ②福林酚试剂乙:在1.5L体积的磨口回流瓶中,加入100g钨酸钠(Na:WO42H0), 25g钼酸钠(Na2Mo04-2Hz0)以及700mL蒸馏水,再加入50mL85%磷酸溶液及100mL浓 盐酸,充分混合,接上回流冷凝管,以小火回流10。回流完毕,加入150g硫酸狸、50m 蒸馏水及数滴液体溴,开口继续沸腾15min,以便除去过量的溴,冷却后加水定容至1000mL 过滤, 滤液呈微绿 色,置于棕色瓶中保存 ,使用时用氧氧化钠标准溶液滴定,以酚酞作指示 剂,最后用蒸馏水稀释(约1倍左右),使最终浓度为1.0mol ①牛血清蛋白标准溶液:精确称取牛血清蛋白或酪蛋白,配制成1O0μgmL溶液。 3.测定 吸取一定量的样品稀释液,加入试剂甲3.0mL,置于25℃中水浴保温10min,再加 入试剂乙0.3mL,立即混匀,保温30m 以介质溶液调零,测定A0m值,与蛋白质 标准液作对照,求出样品的蛋白质的含量 本法在0~一60mg/L蛋白质范围呈良好线性关系 4.说明 福林酚法灵敏度高,实测下限较双缩脲法约小2个数量级。但对双缩脲法有干扰 的物质对福林酚法的影响更大。酚类及柠檬酸均对本法有干扰。 五、考马斯亮蓝染料比色法 1.原理 考马斯亮蓝G一250是一种蛋白质染料,与蛋白质通过范德华引力结合,使蛋白质 染色,在620m处有最大吸收值,可用于蛋白质的定 测定。此法简单而快速,适合 量样品的测定,灵敏度与福林酚法相似,但不受酚类、游离氨基酸和小分子的影响。 2.试剂 ①牛血清蛋白标准液:精确称取牛血清蛋白10mg,用蒸馏水配成1O0μgmL的标准溶
1.25 1.50 0.944 0.804 6.50 0.607 0.595 20.00 0.278 1.16 2.00 0.899 0.784 7.00 0.585 1.00 2.50 0.852 0.767 7.50 0.565 注:表中的数值是由结晶的酵母烯醇化酶和纯的酵母核酸的吸光度计算得来的。一般,纯蛋白质的吸 光度比值(280/260)约为 1.8,而核酸的比值大约为 0.5。 四、福林-酚比色法 1.原理 蛋白质与福林(Folin)-酚试剂反应,产生蓝色复合物。作用机理主要是蛋白质中的肽 键与碱性铜盐产生双缩脲反应,同时也由于蛋白质中存在的酪氨酸与色氨酸同磷钼酸-磷钨 酸试剂反应产生颜色。呈色强度与蛋白质含量成正比,是检测可溶性蛋白质含量最灵敏的经 典方法之一。 2.试剂 ①福林酚试剂甲:将溶液 A50mL 和溶液 B 1mL 混合即成。现用现配,过期失效。 溶液 A:1g Na2CO3 溶于 50mL 0.1mol/LNaOH 溶液中。 溶液 B:将 1%硫酸溶液和 20g/L 酒石酸钠(钾)溶液等体积混合而成。 ②福林酚试剂乙:在 1.5L 体积的磨口回流瓶中,加入 100g 钨酸钠(Na2WO4·2H2O)、 25g 钼酸钠(Na2MoO4·2H2O)以及 700mL 蒸馏水,再加入 50mL85%磷酸溶液及 100mL 浓 盐酸,充分混合,接上回流冷凝管,以小火回流 10h。回流完毕,加入 150g 硫酸锂、50mL 蒸馏水及数滴液体溴,开口继续沸腾 15min,以便除去过量的溴,冷却后加水定容至 1000mL, 过滤,滤液呈微绿色,置于棕色瓶中保存。使用时用氢氧化钠标准溶液滴定,以酚酞作指示 剂,最后用蒸馏水稀释(约 1 倍左右),使最终浓度为 1.0mol/L. ① 牛血清蛋白标准溶液:精确称取牛血清蛋白或酪蛋白,配制成 100μg/mL 溶液。 3.测定 吸取一定量的样品稀释液,加入试剂甲 3.0mL,置于 25℃中水浴保温 10min,再加 入试剂乙 0.3mL,立即混匀,保温 30min,以介质溶液调零,测定 A750nm值,与蛋白质 标准液作对照,求出样品的蛋白质的含量。 本法在 0~60mg/L 蛋白质范围呈良好线性关系。 4.说明 福林-酚法灵敏度高,实测下限较双缩脲法约小 2 个数量级。但对双缩脲法有干扰 的物质对福林酚法的影响更大。酚类及柠檬酸均对本法有干扰。 五、考马斯亮蓝染料比色法 1.原理 考马斯亮蓝 G-250 是一种蛋白质染料,与蛋白质通过范德华引力结合,使蛋白质 染色,在 620nm 处有最大吸收值,可用于蛋白质的定量测定。此法简单而快速,适合大 量样品的测定,灵敏度与福林酚法相似,但不受酚类、游离氨基酸和小分子的影响。 2.试剂 ①牛血清蛋白标准液:精确称取牛血清蛋白 10mg,用蒸馏水配成 100μg/mL 的标准溶

液。 ②染料试剂:称取考马斯亮蓝G-250(Coomassic brilliant blue G-250)60mg溶于 100mL3%过氯酸溶液中,滤去未溶解的染料,贮于棕色瓶中。 3测定 吸取样品稀释液2mL,加染料试剂2mL,混匀,以介质溶液调零,测定A620m,与蛋 白质标准溶液对照,求出样品蛋白质含量。 本法在0一100mg1蛋白质范围内呈良好的线性关系 六、染料结合法 1.原理 在特定条件下,蛋白质可与某些染料(如胺黑10B或酸性橙12等)定量结合而生成沉 淀,用分光光度计测定沉淀反应完成后剩余的染料量可计算出反应消耗的染料量,进而可求 得样品中蛋白质含量 2.适用范围 本法适用于牛乳、冰淇淋、酪乳、巧克力饮料、脱脂乳粉等食品。 3.试剂 ①柠檬酸溶液:称取柠檬酸(含1分子结品水)20.14g,用水稀释至1000mL,加入1.0mL 丙酸(防腐), 摇匀后pH应为22 ②胺黑10B染料溶液:准确称取胺黑10B染料1.066g,用pH22的柠檬酸溶液定容至 1000mL,摇匀,取出1mL,用水稀释至250mL,以水为参比液,用1cm比色皿于615nm 波长处测定吸光度应为0.320:否则用染料柠檬酸溶液或水进行调节。 4。操作方法 ①样品处理:用组织捣碎机将样品粉碎,准确称取一定量(蛋白质含量在370430mg 作标样用 时称四份 (两份凯氏法、两份染料结合法)。如样品脂肪含量高, 用乙醚提取脂 弃去,然后再作试验 ②染料结合:将脱脂肪后样品全部放入组织捣碎机中,准确加入吸光度为0320的染料 溶液200mL,缓慢搅拌4min。 ③过滤离心:将结合后的样品溶液用铺有玻速棉的布氏漏斗自然过滤,或用G,熔结玻 漏斗抽滤,静置20min 取上清夜4mL,用水定容至100mL,摇匀,取出部分溶液离心 5min(2000rmin) ④比色:取离心后的澄清透明溶液,用1cm比色皿,以蒸馏水为参比液于615m波长 处测定吸光度。 ⑤标准曲线的绘制:用凯氏定氢法测出上述两份平行样品的总氨量,进而计算出用于英 剩余的染料所 生的吸光度)为纵冬 以相应蛋白质含堂为横坐标绘图,即得标准曲线。 该标准曲线供分析同类样品蛋白质含量使用。 ⑥测样:完全按照上述(1)~(4)步骤进行,根据测出的吸光度在标准曲线上查得蛋 白质含量即可 6。说明及注意事项 ①取样要均匀。②绘制完整的标准曲线可供同类样品长期使用,而不需要每次测样时都 作标准曲线。③脂肪含量高的样品,应先用乙魅脱脂,然后再测定。④在样品溶解性能不好
液。 ②染料试剂:称取考马斯亮蓝 G-250(Coomassic brilliant blue G-250)60mg,溶于 100mL3%过氯酸溶液中,滤去未溶解的染料,贮于棕色瓶中。 3.测定 吸取样品稀释液 2mL,加染料试剂 2mL,混匀,以介质溶液调零,测定 A620nm,与蛋 白质标准溶液对照,求出样品蛋白质含量。 本法在 0~100mg/L 蛋白质范围内呈良好的线性关系。 六、染料结合法 1.原理 在特定条件下,蛋白质可与某些染料(如胺黑 10B 或酸性橙 12 等)定量结合而生成沉 淀,用分光光度计测定沉淀反应完成后剩余的染料量可计算出反应消耗的染料量,进而可求 得样品中蛋白质含量。 2.适用范围 本法适用于牛乳、冰淇淋、酪乳、巧克力饮料、脱脂乳粉等食品。 3.试剂 ①柠檬酸溶液:称取柠檬酸(含 1 分子结晶水)20.14g,用水稀释至 1000mL,加入 1.0mL 丙酸(防腐),摇匀后 pH 应为 2.2。 ②胺黑 10B 染料溶液:准确称取胺黑 10B 染料 1.066g,用 pH2.2 的柠檬酸溶液定容至 1000mL,摇匀,取出 1mL,用水稀释至 250mL,以水为参比液,用 1cm 比色皿于 615nm 波长处测定吸光度应为 0.320;否则用染料柠檬酸溶液或水进行调节。 4.操作方法 ①样品处理:用组织捣碎机将样品粉碎,准确称取一定量(蛋白质含量在 370~430mg), 作标样用时称四份(两份凯氏法、两份染料结合法)。如样品脂肪含量高,用乙醚提取脂肪 弃去,然后再作试验。 ②染料结合:将脱脂肪后样品全部放入组织捣碎机中,准确加入吸光度为 0.320 的染料 溶液 200mL,缓慢搅拌 4min。 ③过滤离心:将结合后的样品溶液用铺有玻璃棉的布氏漏斗自然过滤,或用 G2 熔结玻 璃漏斗抽滤,静置 20min,取上清夜 4mL,用水定容至 100mL,摇匀,取出部分溶液离心 5min(2000r/min)。 ④比色:取离心后的澄清透明溶液,用 1cm 比色皿,以蒸馏水为参比液于 615nm 波长 处测定吸光度。 ⑤标准曲线的绘制:用凯氏定氮法测出上述两份平行样品的总氮量,进而计算出用于染 料结合法测定的每份平行样的蛋白质含量,以比色测定得到的吸光度(实质是由沉淀反应后 剩余的染料所产生的吸光度)为纵坐标(注意数值最好按从上到下吸光度增大的顺序标出), 以相应蛋白质含量为横坐标绘图,即得标准曲线。 该标准曲线供分析同类样品蛋白质含量使用。 ⑥测样:完全按照上述(1)~(4)步骤进行,根据测出的吸光度在标准曲线上查得蛋 白质含量即可。 6.说明及注意事项 ①取样要均匀。②绘制完整的标准曲线可供同类样品长期使用,而不需要每次测样时都 作标准曲线。③脂肪含量高的样品,应先用乙醚脱脂,然后再测定。④在样品溶解性能不好