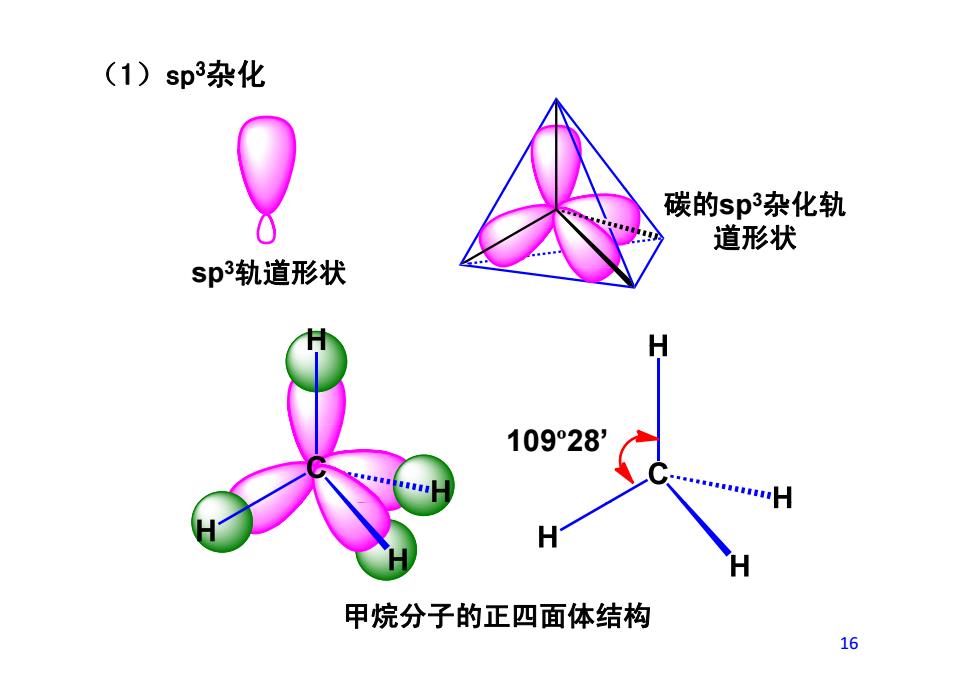
(1)sp3杂化 碳的sp3杂化轨 道形状 Sp3轨道形状 10928' H 甲烷分子的正四面体结构 16
(1)sp3杂化 3轨道形状 碳的sp3杂化轨 道形状 sp3轨道形状 109º28’ 甲烷分子的正四面体结构 16
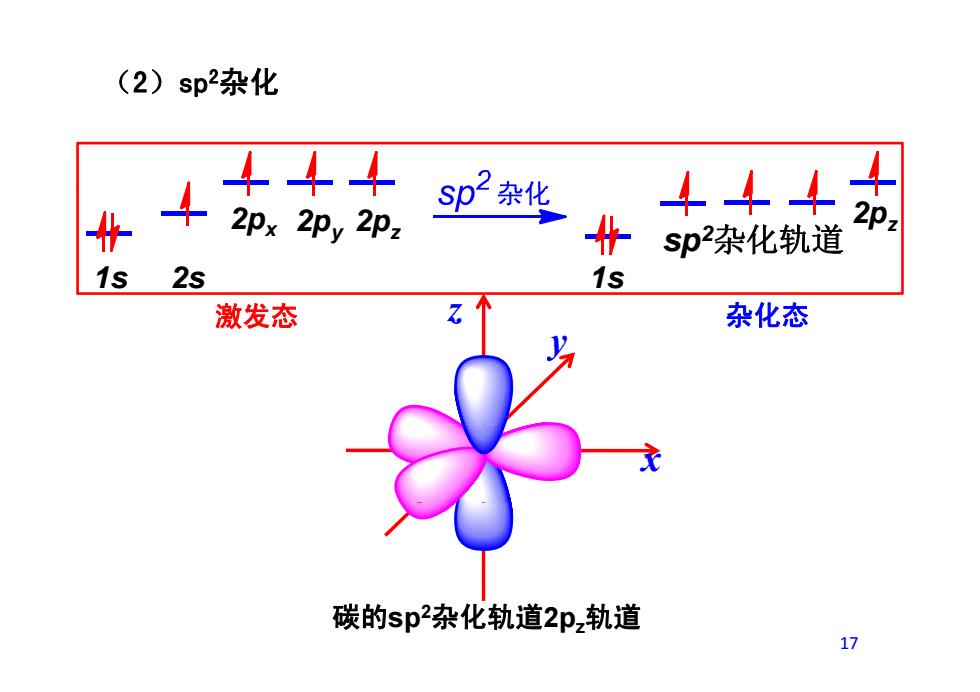
(2)sp2杂化 41 444 2px2py2Pz sp2杂化 444 2p2 sp杂化轨道 1s 2s 1s 激发态 杂化态 碳的sp杂化轨道2pz轨道 17
(2)sp2杂化 1 2 1 2px 2py 2pz sp2杂化轨道 2pz z y 1s 2s 1s 激发态 杂化态 y x 碳的sp2杂化轨道2pz轨道 17

π键 σ键 121.4° 乙烯分子—平面结构 π键:电子云分布有一个密度为零的通过键轴的平面(称为 节面)作为对称面的轨道为π轨道由它形成的键称为π键。 sp杂化的C中,未杂化p,轨道可与O、N等的p轨道形成π 键: C-N- 18
121 4º π键 σ键 121.4 乙烯分子——平面结构 π键:电子云分布有一个密度为零的通过键轴的平面(称为 节面)作为对称面的轨道为π轨道由它形成的键称为π键。 sp2杂化的C中,未杂化pz轨道可与O、N等的p轨道形成π 键: 18
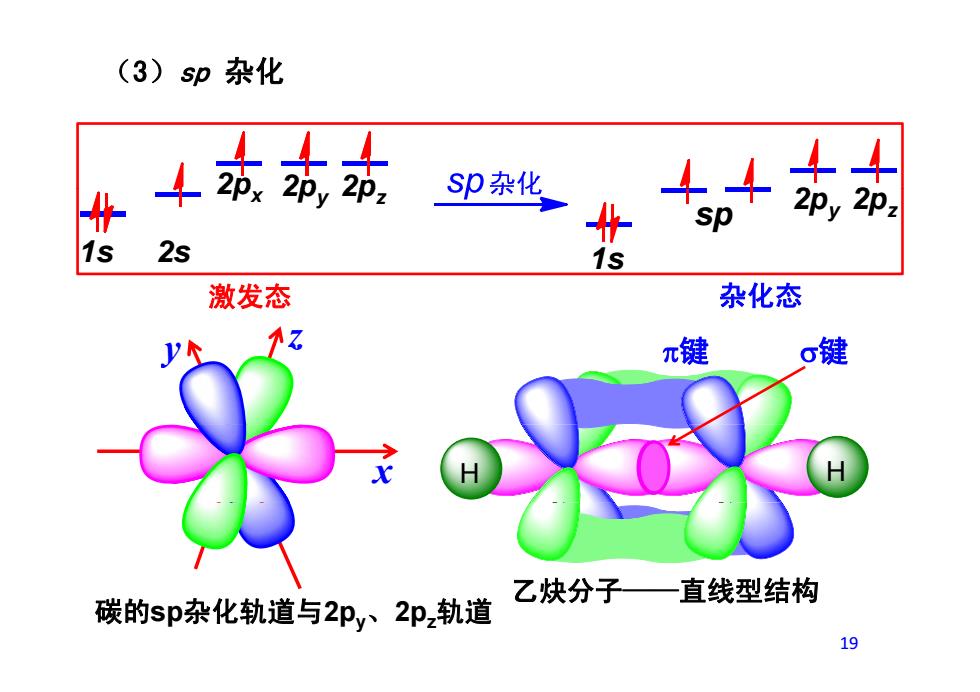
(3)sp杂化 4站站效 Sp杂化 sp 2s 1s 激发态 杂化态 π键 键 乙炔分子一直线型结构 碳的sp杂化轨道与2py、2pz轨道 19
(3)sp 杂化 2p 2p 2p 2 2 1s 2s 1s 2px 2py 2pz sp 2py 2pz z 键 键 1s 激发态 杂化态 y z π键 σ键 x H H 乙炔分子——直线型结构 碳的sp杂化轨道与2py、2pz轨道 19
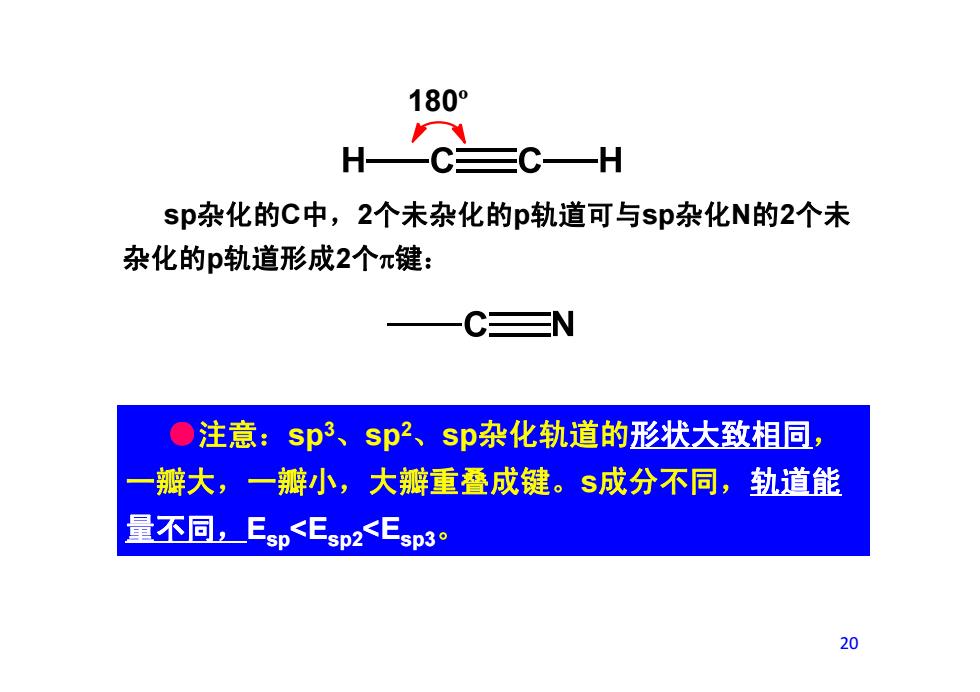
180° HC三C—H sp杂化的C中,2个未杂化的p轨道可与sp杂化N的2个未 杂化的p轨道形成2个π键: ●注意:sp3、sp、sp杂化轨道的形状大致相同, 瓣大,一瓣小,大瓣重叠成键。S成分不同,轨道能 量不同,Esp<Esp2<Esp30 20
180º sp杂化的C中,2个未杂化的p轨道可与sp杂化N的2个未 杂化的p轨道形成2个π键: ●注意:sp3、sp2、sp杂化轨道的形状大致相同, 一瓣大,一瓣小,大瓣重叠成键。s成分不同,轨道能 量不同,Esp<Esp2<Esp3。 20