
共价键:通过电子共用,彼此都达到稳定的电子层结构, 同时共用电子对与两个成键原子核相互吸引而形成的化学键。 由共价键组成的分子为共价型分子。 H+·HHH H+·C:—H:Cl: 金属键:金属原子最外层的价电子很容易脱离原子核的束 缚,然后自由地在由正离子产生的势场中运动,这些自由电 子与正离子互相吸引,使原子紧密堆积起来,形成金属晶体。 这种使金属原子结合成金属晶体的化学键称之为金属键。 金属键无方向性和饱和性。 11
共价键:通过电子共用,彼此都达到稳定的电子层结构, 同时共用电子对与两个成键原子核相互吸引而形成的化学键。 由共价键组成的分子为共价型分子。 金属键:金属原子最外层的价电子很容易脱离原子核的束 缚,然后自由地在由正离子产生的势场中运动,这些自由电 子与正离子互相吸引,使原子紧密堆积起来,形成金属晶体。 这种使金属原子结合成金属晶体的化学键称之为金属键。 金属键无方向性和饱和性 11 z 金属键无方向性和饱和性

一、 共价键的形成 对于共价键形成的理论解释,常用价键理论和分子轨道理论。 1、价键理论 定域观点—形成共价键的电子在两个原子相连接的区 域内运动。主要内容: 1)小、电子“配对”形成共价键 组成分子的原子,如果具有未成对电子且自旋反平行时, 就可偶合成对,每一对电子成为一个共价键。也就是说, 共价键的形成来自于原子轨道的重叠,在重叠的原子轨道 上有2个自旋相反的电子。这就是电子“配对”,电子 “配对”形成共价键,放出能量。 12
一、共价键的形成 对于共价键形成的理论解释,常用价键理论和分子轨道理论。 1、价键理论 定域观点——形成共价键的电子在两个原子相连接的区 1) 电子“配对”形成共价键 定域观点 形成共价键的电子在两个原子相连接的区 域内运动。主要内容: 1)、电子“配对”形成共价键 组成分子的原子,如果具有未成对电子且自旋反平行时, 就可偶合成对,每一对电子成为一个共价键。也就是说, 共价键的形成来自于原子轨道的重叠,在重叠的原子轨道 上有2个自旋相反的电子。这就是电子“配对”, 电子 12 “配对”形成共价键,放出能量
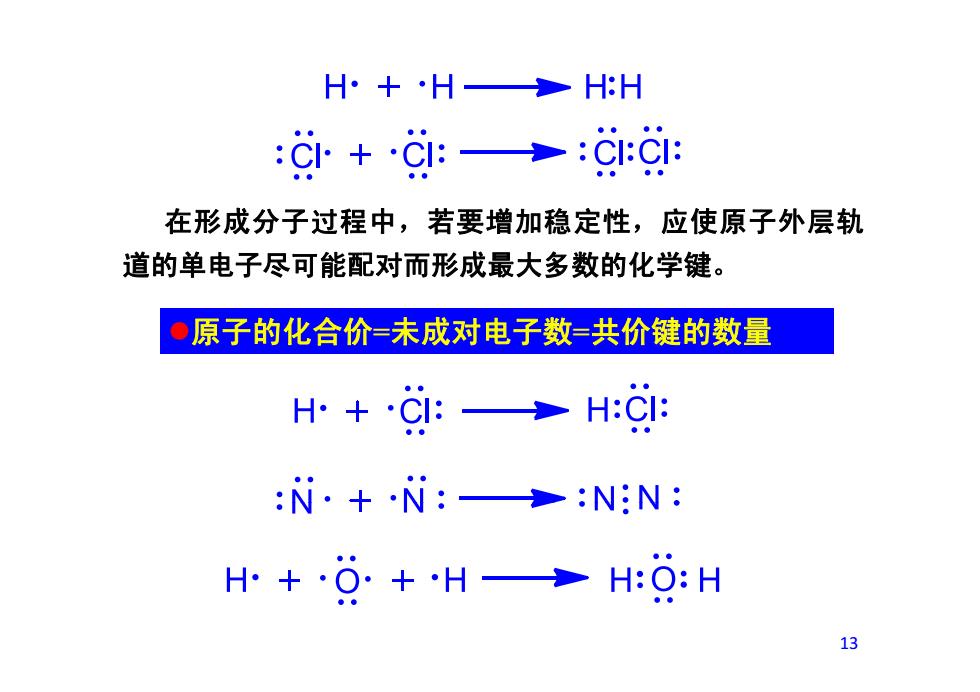
H+·H。HH CI+CI::CI:CI: 在形成分子过程中,若要增加稳定性,应使原子外层轨 道的单电子尽可能配对而形成最大多数的化学键。 原子的化合价=未成对电子数=共价键的数量 H+·G:H:C: :N.+N::NN: H+·O+HH:O:H 13
在形成分子过程中,若要增加稳定性,应使原子外层轨 道的单电子尽可能配对而形成最大多数的化学键 。 z原子的化合价 =未成对电子数 =共价键的数量 13
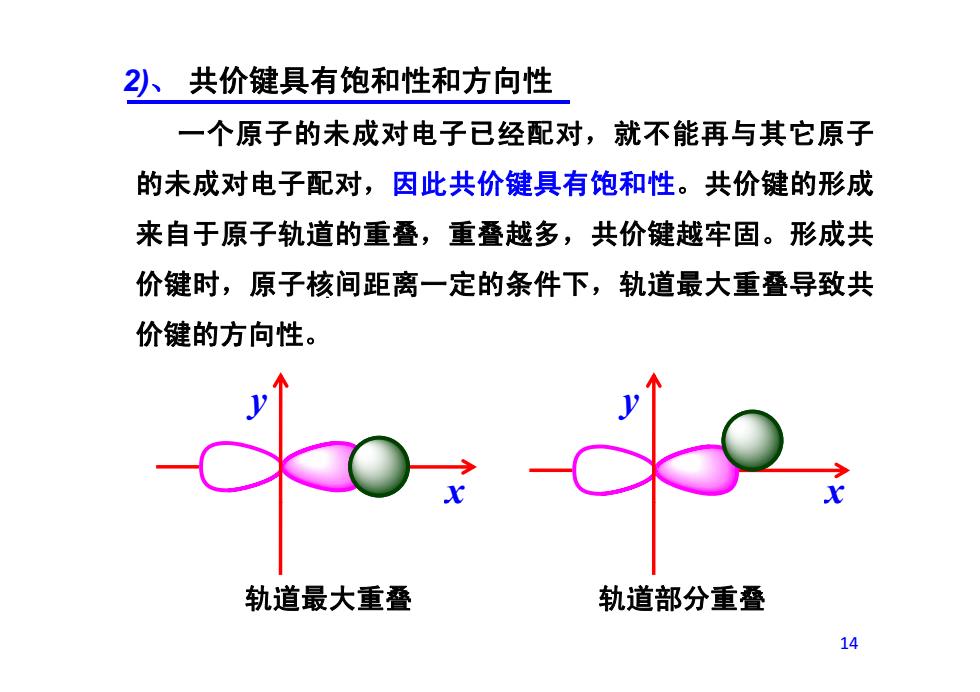
2)、共价键具有饱和性和方向性 一个原子的未成对电子已经配对,就不能再与其它原子 的未成对电子配对,因此共价键具有饱和性。共价键的形成 来自于原子轨道的重叠,重叠越多,共价键越牢固。形成共 价键时,原子核间距离一定的条件下,轨道最大重叠导致共 价键的方向性。 o. 轨道最大重叠 轨道部分重叠 14
2)、 共价键具有饱和性和方向性 一个原子的未成对电子已经配对,就不能再与其它原子 的未成对电子配对,因此共价键具有饱和性。共价键的形成 来自于原子轨道的重叠,重叠越多,共价键越牢固。形成共 价键时,原子核间距离一定的条件下,轨道最大重叠导致共 价键的方向性。 y y x x 14 轨道最大重叠 轨道部分重叠
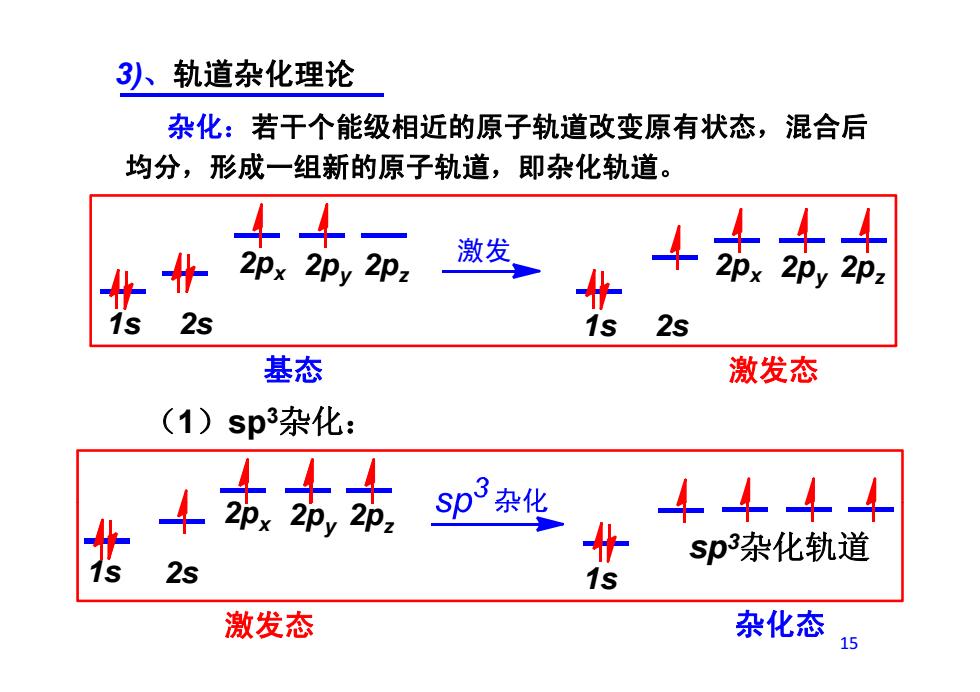
3八、轨道杂化理论 杂化:若干个能级相近的原子轨道改变原有状态,混合后 均分,形成一组新的原子轨道,即杂化轨道。 44 冬 2px 2py 2pz 激发 4茹站 2s 2s 基态 激发态 (1)sp3杂化: 1东站动 sp3杂化 4444 指 sp杂化轨道 2s 1s 激发态 杂化态 15
3)、轨道杂化理论 杂化:若干个能级相近的原子轨道改变原有状态,混合后 均分,形成一组新的原子轨道,即杂化轨道。 2p 激发 2p 2p 2p 2p 2p 1s 2s 2px 2py 2pz 1s 2s 2px 2py 2pz (1)sp3杂化: 基态 激发态 (1)sp 杂化: 2 1s 2s 1s px 2py 2pz sp3杂化轨道 激发态 杂化态 15 1s 2s 1s