
第二类导体又称离子导体,如电解质溶液、熔融电解质等 第二类导体的特点是: A.正、负离子作反向移动而导电,导电总量分别 由正、负离子分担 B.电解质溶液的连续导电过程必须在电化学装置中实现, 而且总是伴随有电化学反应和化学能与电能相互转换发 生。 C.温度升高,电阻下降 6
6 第二类导体又称离子导体,如电解质溶液、熔融电解质等 第二类导体的特点是: A. 正、负离子作反向移动而导电,导电总量分别 由正、负离子分担 B. 电解质溶液的连续导电过程必须在电化学装置中实现, 而且总是伴随有电化学反应和化学能与电能相互转换发 生。 C. 温度升高,电阻下降

1.1基本概念 (2)电极 正极、负极 正极: 电势高的极称为正极,电流从正极 流向负极。 负极: 电势低的极称为负极,电子从负极 流向正极。 7
7 正极、负极 电势低的极称为负极,电子从负极 流向正极。 负极: 电势高的极称为正极,电流从正极 流向负极。 正极: 1.1 基本概念 (2)电极
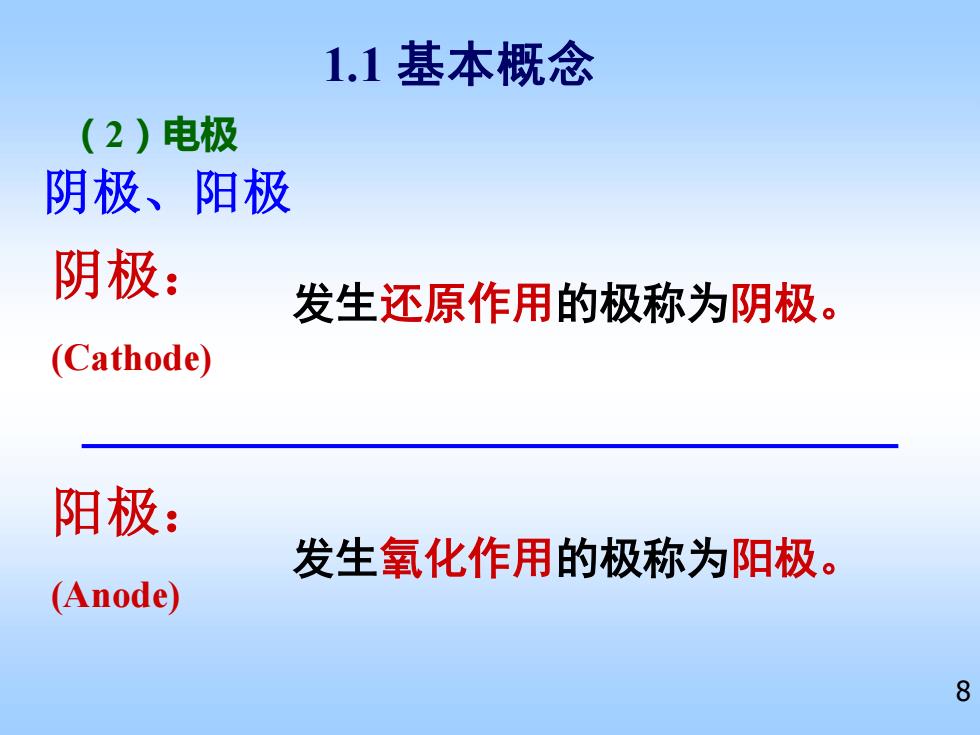
1.1基本概念 (2)电极 阴极、阳极 阴极: 发生还原作用的极称为阴极。 (Cathode) 阳极: 发生氧化作用的极称为阳极。 (Anode) 8
8 阴极、阳极 阴极: 发生还原作用的极称为阴极。 (Cathode) 发生氧化作用的极称为阳极。 阳极: (Anode) 1.1 基本概念 (2)电极

1.1基本概念 (2)电极 电极反应:电极上进行的有电子得失的化学反应 阳极:HL2(g)→2Ht(m)+2e 阴极:C2(g+2e→2C(m) 电池反应:两个电极反应的总结果表示电池反应 以上电极反应的总反应为: H2(g)+Cl2(g)->2HCI(m) 9
9 1.1 基本概念 (2)电极 电极反应:电极上进行的有电子得失的化学反应 电池反应:两个电极反应的总结果表示电池反应 阳极: H2 (g)→2H+ (m)+ 2e- 阴极: Cl2 (g)+2e - →2Cl- (m) 以上电极反应的总反应为: H2 (g)+Cl2 (g)→2HCl(m)
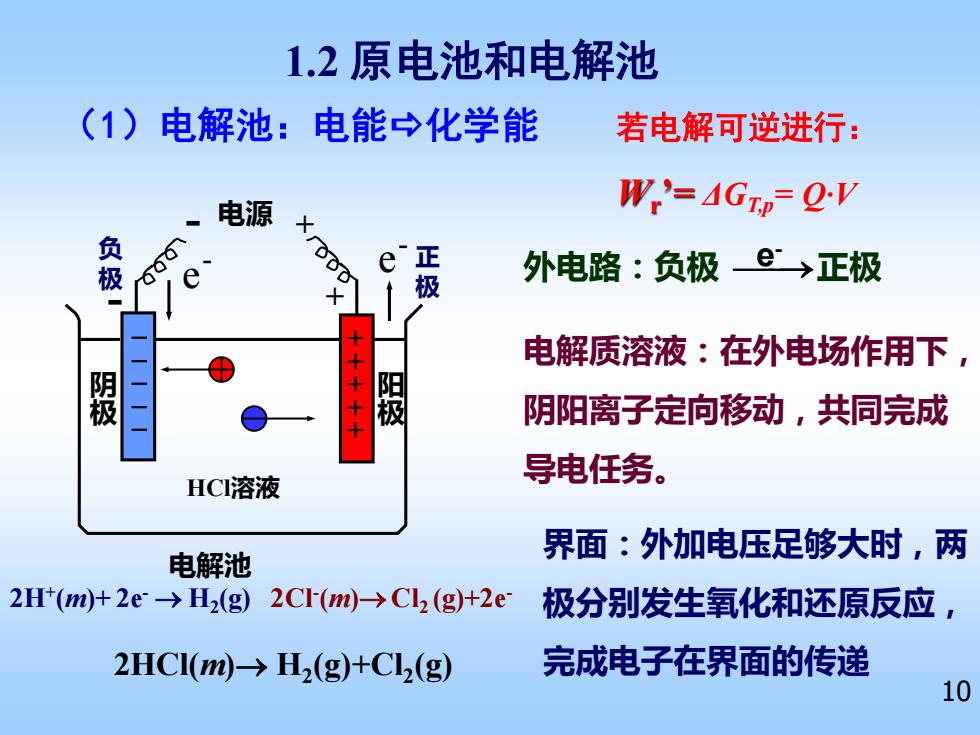
1.2原电池和电解池 (1)电解池:电能→化学能 若电解可逆进行: 电源 Wr'=AGTD=QV X 负 正 极 外电路:负极e→正极 十 极 电解质溶液:在外电场作用下, ⊕ 极 极 阴阳离子定向移动,共同完成 HCI溶液 导电任务。 界面:外加电压足够大时,两 电解池 2H(m)+2e-→H2(g)2C(m)→Cl2(g+2e 极分别发生氧化和还原反应, 2HCI(m)>H2(g)+Cl(g) 完成电子在界面的传递 10
10 HCl溶液 - 电源 + 电解池 + - e - e - 电解质溶液:在外电场作用下, 阴阳离子定向移动,共同完成 导电任务。 (1)电解池:电能化学能 1.2 原电池和电解池 负 极 正 极 2HCl(m)→ H2 (g)+Cl2 (g) 2Cl- (m)→Cl2 (g)+2e- 2H+ (m)+ 2e- → H2 (g) 阴 极 阳 极 外电路:负极 ⎯⎯→ e 正极 - 界面:外加电压足够大时,两 极分别发生氧化和还原反应, 完成电子在界面的传递 若电解可逆进行: Wr ’= ΔGT,p= Q·V - - - - - + + + + +