
《无机化学C》教学大纲 课程类别:学科基础课 课程性质:必修 英文名称:Inorganic Chemistry 总学时:32 学分: 2 适用专业:临床医学、口腔医学 开课单位:环境与化学工程学院 课程简介 《无机化学》是综合性大学临床与口腔专业本科生一门重要的公共基础课。它的理 论和方法是从事临床和口腔医学工作的基础。这门课程结合医学专业对化学基础知识的 要求,讲授无机化学的基本原理和方法,熟练掌握无机化学基本概念,基本计算。掌握 溶液理论和溶液中的四大化学平衡及基础电化学的基本理论。逐步培养学生应用所学的 基本理论,学会分析与解决实际问题的能力,为后续课程的学习及今后从事医学理论和 应用研究打下良好的基础。 二、课程内容、基本要求与学时分配 第一章溶液和胶体分散体系(2学时) 教学内容: 11溶液的组成标度 1.2稀溶液的依数性1.3胶体溶液 教学要求: 1.掌握溶液浓度的表示方法和计算方法(物质的量浓度、质量摩尔浓度、摩尔分 数以及它们之间的换算)。2.理解稀溶液的依数性及其应用。 3.了解胶体溶液的结构、性质。了解大分子溶液与凝胶。 授课方式:讲授+自学 第二章化学热力学(4学时) 教学内容: 2.1热力学第一定律2.2热化学2.3化学反应的方向 2.4化学反应的摩尔吉布斯函数变的计算 教学要求: 1.了解化学热力学的一些常用术语。2.理解热力学第一、二、三定律的基本内容 3.掌握化学反应的标准摩尔焓变的各种计算方法。 4.掌握化学反应的标准摩尔熵变和标准摩尔Gibbs自由能变(△G)的计算方法。 5.会用△G来判断化学反应的方向,并了解温度对△G的影响。 授课方式:讲授+讨论 第三章化学平衡 (2学时) 教学内容: 3.1标准平衡常数及标准平衡常数的应用3.2化学平衡的移动 教学要求: 1,理解并掌握标准平衡常数的概念,表示方法。 2.理解化学反应等温式,能根据化学反应等温式判断反应方向
《无机化学C》教学大纲 课程类别:学科基础课 课程性质:必修 英文名称:Inorganic Chemistry 总学时: 32 学分: 2 适用专业:临床医学、口腔医学 开课单位:环境与化学工程学院 一、课程简介 《无机化学》是综合性大学临床与口腔专业本科生一门重要的公共基础课。它的理 论和方法是从事临床和口腔医学工作的基础。这门课程结合医学专业对化学基础知识的 要求,讲授无机化学的基本原理和方法,熟练掌握无机化学基本概念,基本计算。掌握 溶液理论和溶液中的四大化学平衡及基础电化学的基本理论。逐步培养学生应用所学的 基本理论,学会分析与解决实际问题的能力,为后续课程的学习及今后从事医学理论和 应用研究打下良好的基础。 二、课程内容、基本要求与学时分配 第一章 溶液和胶体分散体系 (2 学时) 教学内容: 1.1 溶液的组成标度 1.2 稀溶液的依数性 1.3 胶体溶液 教学要求: 1.掌握溶液浓度的表示方法和计算方法(物质的量浓度、质量摩尔浓度、摩尔分 数以及它们之间的换算)。 2.理解稀溶液的依数性及其应用。 3.了解胶体溶液的结构、性质。了解大分子溶液与凝胶。 授课方式:讲授+自学 第二章 化学热力学 (4 学时) 教学内容: 2.1 热力学第一定律 2.2 热化学 2.3 化学反应的方向 2.4 化学反应的摩尔吉布斯函数变的计算 教学要求: 1.了解化学热力学的一些常用术语。 2.理解热力学第一、二、三定律的基本内容。 3.掌握化学反应的标准摩尔焓变的各种计算方法。 4.掌握化学反应的标准摩尔熵变和标准摩尔 Gibbs 自由能变(ΔG)的计算方法。 5.会用ΔG 来判断化学反应的方向,并了解温度对ΔG 的影响。 授课方式:讲授+讨论 第三章 化学平衡 (2 学时) 教学内容: 3.1 标准平衡常数及标准平衡常数的应用 3.2 化学平衡的移动 教学要求: 1.理解并掌握标准平衡常数的概念,表示方法。 2.理解化学反应等温式,能根据化学反应等温式判断反应方向

3.堂根有关化学平衡的计算,句括云用多重平衡期则讲行计算。 4.理解化学平衡移动原理,会分析各种外界因素影响下化学平衡移动的方向。 授课方式:讲授+讨论 第四章化学反应速率 (2学时) 教学内容: 4.1化学反应速率及其表示方法4.2浓度对反应速率的影响 4.3温度对反应速率的影响4.4催化剂对反应速率的影响 教学要求: 1,掌握化学反应速率的概念,了解实验测定方法。 2.掌握质量作用定律和化学反应的速率方程式。 3.理解温度与反应速率关系的阿仑尼乌斯经验式,并能用活化分子、活化能等概念 解释各种外界因素对反应速率的影响。 授课方式:讲授+讨论 第五章酸碱平衡 (4学时) 教学内容 5.1基本概念5.2酸碱质子理论5.3弱酸、弱碱的解离平衡 5.4一元弱酸 一元弱碱有关浓度的简单计算 5.5缓冲溶液 教学要求: 1,掌握酸碱质子理论。2.掌握一元弱酸、一元弱碱平衡中有关浓度的计算。 3理解酸碱缓冲溶液及其应用,掌握缓冲溶液pH值的计算。 授课方式:讲授+自学 第六章难容强电解质的沉淀-溶解平衡(2学时) 教学内容: 6.1标准溶度积常数 6.2沉淀的生成和溶解 教学要求: 】,理解沉淀的溶度积和溶解度概令,了解溶府积规测 2.理解影响沉淀溶解度的因素。 授课方式:讲授+自学 第七章氧化还原反应和电极电势 (4学时) 教学内容: 7.1氧化还原反应的基本概念72电极电势和原电池的电动势 7.3电极电势的应用 教学要求: 1,握氧化还原的本质,熟悉反应方程式的配平,理解氧化数的概念。 2.理解电极电势的概念和能斯特方程式。 3.理解原电池、标准电极电势及物理意义。 授课方式:讲授+自学 第八章原子结构和元素周期律 (4学时) 教学内容: 8.1微观粒子的特征3.2核外电子运动状态
3.掌握有关化学平衡的计算,包括运用多重平衡规则进行计算。 4.理解化学平衡移动原理,会分析各种外界因素影响下化学平衡移动的方向。 授课方式:讲授+讨论 第四章 化学反应速率 (2 学时) 教学内容: 4.1 化学反应速率及其表示方法 4.2 浓度对反应速率的影响 4.3 温度对反应速率的影响 4.4 催化剂对反应速率的影响 教学要求: 1.掌握化学反应速率的概念,了解实验测定方法。 2.掌握质量作用定律和化学反应的速率方程式。 3.理解温度与反应速率关系的阿仑尼乌斯经验式,并能用活化分子、活化能等概念 解释各种外界因素对反应速率的影响。 授课方式:讲授+讨论 第五章 酸碱平衡 (4 学时) 教学内容: 5.1 基本概念 5.2 酸碱质子理论 5.3 弱酸、弱碱的解离平衡 5.4 一元弱酸、一元弱碱有关浓度的简单计算 5.5 缓冲溶液 教学要求: 1.掌握酸碱质子理论。2.掌握一元弱酸、一元弱碱平衡中有关浓度的计算。 3.理解酸碱缓冲溶液及其应用,掌握缓冲溶液 pH 值的计算。 授课方式:讲授+自学 第六章 难容强电解质的沉淀-溶解平衡 (2 学时) 教学内容: 6.1 标准溶度积常数 6.2 沉淀的生成和溶解 教学要求: 1.理解沉淀的溶度积和溶解度概念,了解溶度积规则。 2.理解影响沉淀溶解度的因素。 授课方式:讲授+自学 第七章 氧化还原反应和电极电势 (4 学时) 教学内容: 7.1 氧化还原反应的基本概念 7.2 电极电势和原电池的电动势 7.3 电极电势的应用 教学要求: 1.掌握氧化还原的本质,熟悉反应方程式的配平,理解氧化数的概念。 2.理解电极电势的概念和能斯特方程式。 3.理解原电池、标准电极电势及物理意义。 授课方式:讲授+自学 第八章 原子结构和元素周期律 (4 学时) 教学内容: 8.1 微观粒子的特征 3.2 核外电子运动状态

3.3元素性质与元素周期律 教学要求: 1.了解核外电子运动的特殊性一波、粒二象性 2.理解波函数的角度分布图。 3.理解描述核外电子运动状态的四个量子数的物理意义:掌握电子层、电子亚层、 能级和轨道等含义。 4.能运用不相容原理、能量最低原理和洪特规则写出一般元素的原子核外电子排布 式和价电子构型式。 授课方式:讲授+讨论 第九章分子结构 (4学时) 教学内容: 9.1离子键9.2共价键的价键理论9.3分子间作用力和氢键 教学要求: 1.学习化学键理论(离子键理论和共价键理论)。了解离子化合物和共价化合物的 特征。 2.了解分子间作用力。会根据分子间作用力解释物质的物理性质。 授课方式:讲授+讨论 第十章:配位化合物(4学时) 教学内容: 10.1配位化合物的基本概念10.2配位化合物的化学键理论10.3配位平衡 教学要求: 1.掌握配合物的概念,熟悉配合物的组成、命名和分类方法。 2.理解配合物的价键理论。3.掌握配位平衡常数一 一衡量配合物稳定性的指标。 4.了解配位平衡的移动规律。 授课方式:讲授+讨论 三、其它教学环节安排 另有无机化学实验32学时 四、考核方式 本课程成绩根据作业、期中考核和期末闭卷考试进行评定,课程成绩以百分制计算 分配比例如下: 1.平时成绩20-30% 2.期末成结70-80% 五、教材及主要参考书 1.使用教材:徐春祥,《基础化学》(第二版),高等教育出版社,2003.8 2主要参考书: (1)许善锦主编,《无机化学》(第四版),人民卫生出版社,2006.6 (2)浙江大学编,《无机及分析化学》,高等教育出版社,2003.7 (3)大连理工大学无机化学教研室主编,《无机化学》(第五版),高等教育出版社 2006.9. 耀写人:于援 审核人:尤慧艳 课程负责人:尤慧艳
3.3 元素性质与元素周期律 教学要求: 1.了解核外电子运动的特殊性—波、粒二象性。 2.理解波函数的角度分布图。 3.理解描述核外电子运动状态的四个量子数的物理意义;掌握电子层、电子亚层、 能级和轨道等含义。 4.能运用不相容原理、能量最低原理和洪特规则写出一般元素的原子核外电子排布 式和价电子构型式。 授课方式:讲授+讨论 第九章 分子结构 (4 学时) 教学内容: 9.1 离子键 9.2 共价键的价键理论 9.3 分子间作用力和氢键 教学要求: 1.学习化学键理论(离子键理论和共价键理论)。了解离子化合物和共价化合物的 特征。 2.了解分子间作用力。会根据分子间作用力解释物质的物理性质。 授课方式:讲授+讨论 第十章:配位化合物 (4 学时) 教学内容: 10.1 配位化合物的基本概念 10.2 配位化合物的化学键理论 10.3 配位平衡 教学要求: 1.掌握配合物的概念,熟悉配合物的组成、命名和分类方法。 2.理解配合物的价键理论。 3.掌握配位平衡常数——衡量配合物稳定性的指标。 4.了解配位平衡的移动规律。 授课方式:讲授+讨论 三、其它教学环节安排 另有无机化学实验 32 学时 四、考核方式 本课程成绩根据作业、期中考核和期末闭卷考试进行评定,课程成绩以百分制计算, 分配比例如下: 1.平时成绩 20-30%。 2.期末成绩 70-80%。 五、教材及主要参考书 1.使用教材:徐春祥,《基础化学》(第二版),高等教育出版社,2003.8 2.主要参考书: (1)许善锦主编,《无机化学》(第四版),人民卫生出版社,2006.6 (2)浙江大学编,《无机及分析化学》,高等教育出版社,2003.7 (3)大连理工大学无机化学教研室主编,《无机化学》(第五版),高等教育出版社, 2006.9. 撰写人:于媛 审核人:尤慧艳 课程负责人:尤慧艳
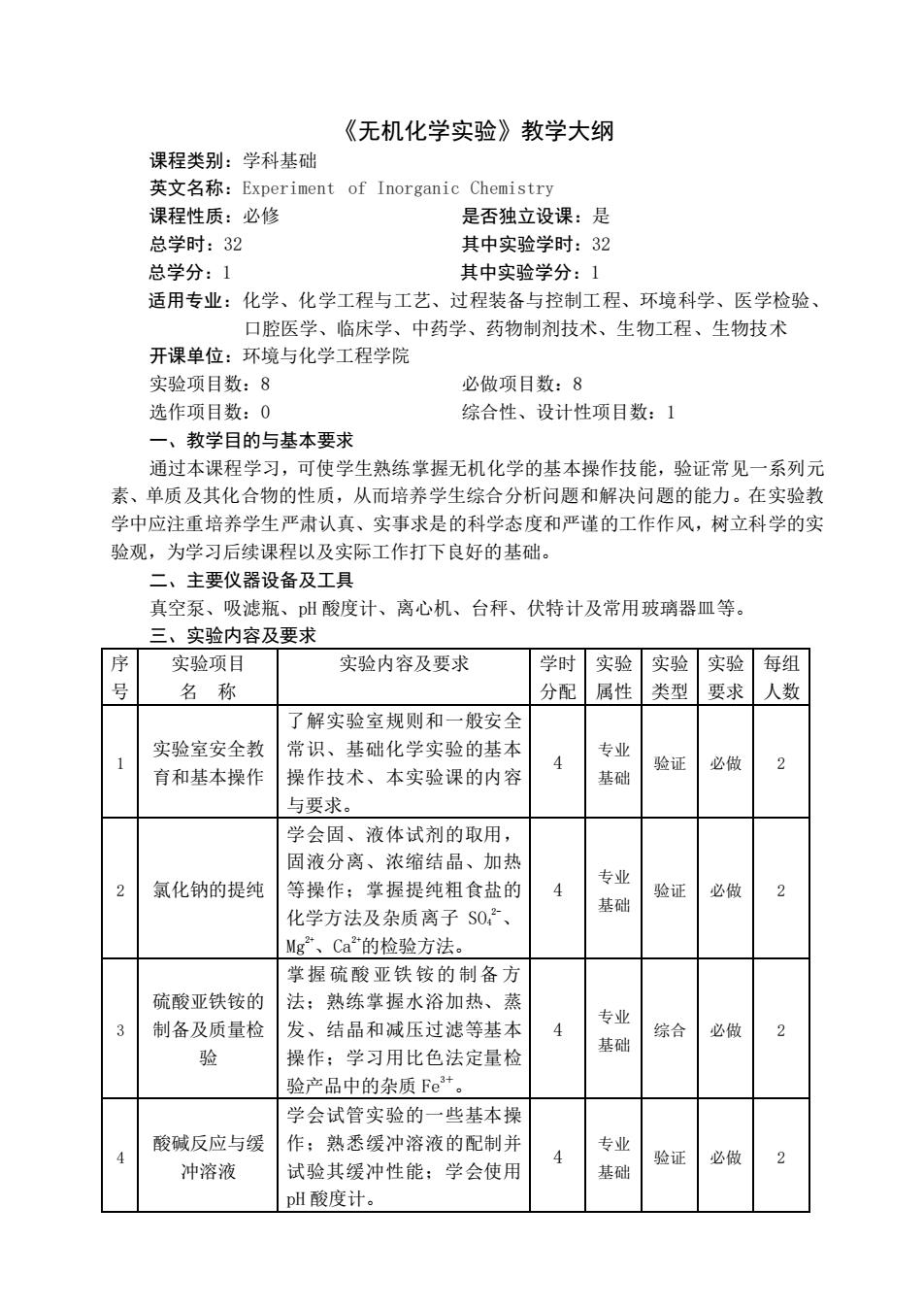
《无机化学实验》教学大纲 课程类别:学科基础 英文名称:Experiment of Inorganic Chemistry 课程性质:必修 是否独立设课:是 总学时:32 其中实验学时:32 总学分:1 其中实验学分:1 适用专业:化学、化学工程与工艺、过程装备与控制工程、环境科学、医学检验、 口腔医学、临床学、中药学、药物制剂技术、生物工程、生物技术 开课单位:环境与化学工程学院 实验项目数:8 必做项目数:8 选作项目数:0 综合性、设计性项目数:1 一、教学目的与基本要求 通过本课程学习,可使学生熟练掌握无机化学的基本操作技能,验证常见一系列元 素、单质及其化合物的性质,从而培养学生综合分析问题和解决问题的能力。在实验教 学中应注重培养学生严肃认真、实事求是的科学态度和严谨的工作作风,树立科学的实 验观,为学习后续课程以及实际工作打下良好的基础。 二、主要仪器设备及工具 真空泵、吸滤瓶、pH酸度计、离心机、台秤、伏特计及常用玻璃器皿等。 三、实验内容及要求 序 实验项目 实验内容及要求 学时实验 实验实验每组 名称 分配属性类型要求人数 了解实验室规则和一般安全 实验室安全教 常识、基础化学实验的基本 专业 验证 必做 2 育和基本操作 操作技术、本实验课的内容 基础 与要求。 学会固、液体试剂的取用, 固液分离、浓缩结晶、加热 专业 2 氯化钠的提纯 等操作:掌握提纯粗食盐的 2 化学方法及杂质离子$02 基础 验证必做 Mg2、Ca的检验方法。 掌握硫酸亚铁铵的制备方 硫酸亚铁铵的 法:熟练掌握水浴加热、蒸 专业 3 制备及质量检 发 ,结晶和减压过滤等基本 4 综合 必做 2 基础 操作:学习用比色法定量检 验产品中的杂质Fe+。 学会试管实验的一些基本操 酸碱反应与缓 作:熟悉缓神溶液的配制并 专业 9 冲溶液 试验其缓冲性能:学会使用 基础 验证 必做 DH酸度计
《无机化学实验》教学大纲 课程类别:学科基础 英文名称:Experiment of Inorganic Chemistry 课程性质:必修 是否独立设课:是 总学时:32 其中实验学时:32 总学分:1 其中实验学分:1 适用专业:化学、化学工程与工艺、过程装备与控制工程、环境科学、医学检验、 口腔医学、临床学、中药学、药物制剂技术、生物工程、生物技术 开课单位:环境与化学工程学院 实验项目数:8 必做项目数:8 选作项目数:0 综合性、设计性项目数:1 一、教学目的与基本要求 通过本课程学习,可使学生熟练掌握无机化学的基本操作技能,验证常见一系列元 素、单质及其化合物的性质,从而培养学生综合分析问题和解决问题的能力。在实验教 学中应注重培养学生严肃认真、实事求是的科学态度和严谨的工作作风,树立科学的实 验观,为学习后续课程以及实际工作打下良好的基础。 二、主要仪器设备及工具 真空泵、吸滤瓶、pH 酸度计、离心机、台秤、伏特计及常用玻璃器皿等。 三、实验内容及要求 序 号 实验项目 名 称 实验内容及要求 学时 分配 实验 属性 实验 类型 实验 要求 每组 人数 1 实验室安全教 育和基本操作 了解实验室规则和一般安全 常识、基础化学实验的基本 操作技术、本实验课的内容 与要求。 4 专业 基础 验证 必做 2 2 氯化钠的提纯 学会固、液体试剂的取用, 固液分离、浓缩结晶、加热 等操作;掌握提纯粗食盐的 化学方法及杂质离子 SO4 2-、 Mg2+、Ca2+的检验方法。 4 专业 基础 验证 必做 2 3 硫酸亚铁铵的 制备及质量检 验 掌握 硫酸 亚铁 铵的 制备 方 法;熟练掌握水浴加热、蒸 发、结晶和减压过滤等基本 操作;学习用比色法定量检 验产品中的杂质 Fe3+。 4 专业 基础 综合 必做 2 4 酸碱反应与缓 冲溶液 学会试管实验的一些基本操 作;熟悉缓冲溶液的配制并 试验其缓冲性能;学会使用 pH 酸度计。 4 专业 基础 验证 必做 2
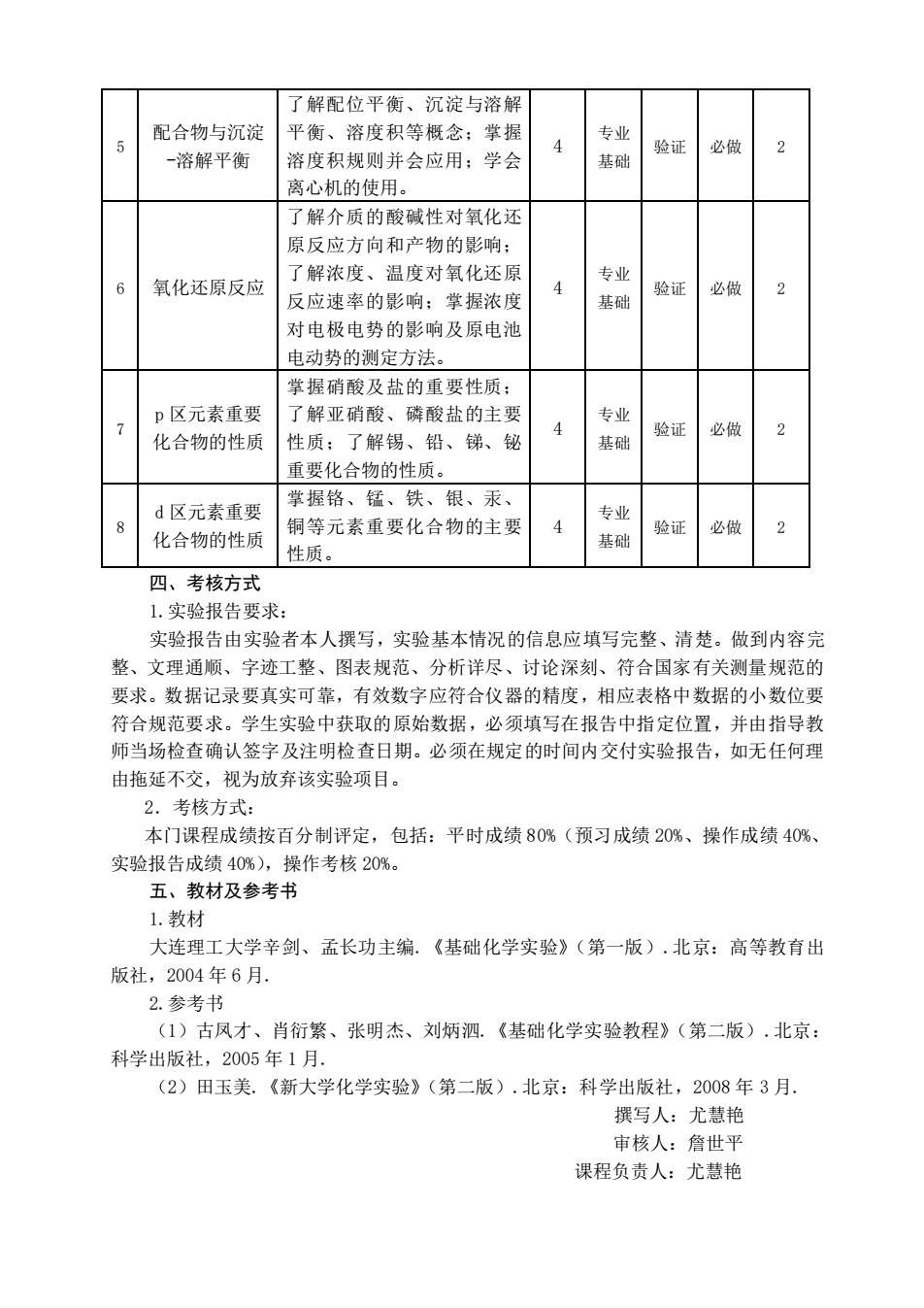
了解配位平衡、沉淀与溶解 配合物与沉淀 平衡、溶度积等概念:掌握 专业 5 -溶解平衡 溶度积规则并会应用:学会 基础 验证 必做 离心机的使用。 了解介质的酸碱性对氧化还 原反应方向和产物的影响: 氧化还原反应 了解浓度、温度对氧化还原 专业 6 4 2 反应速率的影响:掌握浓度 基础 验证 必做 对电极电势的影响及原电泄 电动势的测定方法 学握硝酸及盐的重要性质: n风元素重要 了解亚硝酸、磷酸盐的主要 专业 化合物的性质 性质:了解锡、铅、锑、铋 验证 必做 2 基础 重要化合物的性质。 d区元素重要 掌握铬、锰、铁、银、汞、 专业 铜等元素重要化合物的主要 A 化合物的性质 基础 验证 必做 2 性质。 四、考核方式 1.实验报告要求 实验报告由实验者本人撰写,实验基本情况的信息应填写完整、清楚。做到内容完 整、文理通顺、字迹工整、图表规范、分析详尽、讨论深刻、符合国家有关测量规范的 要求。数据记录要真实可靠,有效数字应符合仪器的精度,相应表格中数据的小数位要 符合规范要求。学生实验中获取的原始数据,必须填写在报告中指定位置,并由指导教 师当场检查确认签字及注明检查日期。必须在规定的时间内交付实验报告,如无任何理 由拖延不交,视为放弃该实验项目。 2.考核方式: 本门课程成绩按百分制评定,包括:平时成绩80%(预习成绩20%、操作成绩40%、 实验报告成绩40%),操作考核20%。 五、教材及参考书 1.教材 大连理工大学辛剑、孟长功主编。《基础化学实验》(第一版).北京:高等教育出 版社,2004年6月. 2.参考书 (1)古凤才、肖衍繁、张明杰、刘炳泅。《基础化学实验教程》(第二版).北京: 科学出版社,2005年1月。 (2)田玉美.《新大学化学实验》(第二版),北京:科学出版社,2008年3月. 撰写人:尤慧艳 审核人:詹世平 课程负责人:尤慧艳
5 配合物与沉淀 -溶解平衡 了解配位平衡、沉淀与溶解 平衡、溶度积等概念;掌握 溶度积规则并会应用;学会 离心机的使用。 4 专业 基础 验证 必做 2 6 氧化还原反应 了解介质的酸碱性对氧化还 原反应方向和产物的影响; 了解浓度、温度对氧化还原 反应速率的影响;掌握浓度 对电极电势的影响及原电池 电动势的测定方法。 4 专业 基础 验证 必做 2 7 p 区元素重要 化合物的性质 掌握硝酸及盐的重要性质; 了解亚硝酸、磷酸盐的主要 性质;了解锡、铅、锑、铋 重要化合物的性质。 4 专业 基础 验证 必做 2 8 d 区元素重要 化合物的性质 掌握铬、锰、铁、银、汞、 铜等元素重要化合物的主要 性质。 4 专业 基础 验证 必做 2 四、考核方式 1.实验报告要求: 实验报告由实验者本人撰写,实验基本情况的信息应填写完整、清楚。做到内容完 整、文理通顺、字迹工整、图表规范、分析详尽、讨论深刻、符合国家有关测量规范的 要求。数据记录要真实可靠,有效数字应符合仪器的精度,相应表格中数据的小数位要 符合规范要求。学生实验中获取的原始数据,必须填写在报告中指定位置,并由指导教 师当场检查确认签字及注明检查日期。必须在规定的时间内交付实验报告,如无任何理 由拖延不交,视为放弃该实验项目。 2.考核方式: 本门课程成绩按百分制评定,包括:平时成绩 80%(预习成绩 20%、操作成绩 40%、 实验报告成绩 40%),操作考核 20%。 五、教材及参考书 1.教材 大连理工大学辛剑、孟长功主编.《基础化学实验》(第一版).北京:高等教育出 版社,2004 年 6 月. 2.参考书 (1)古凤才、肖衍繁、张明杰、刘炳泗.《基础化学实验教程》(第二版).北京: 科学出版社,2005 年 1 月. (2)田玉美.《新大学化学实验》(第二版).北京:科学出版社,2008 年 3 月. 撰写人:尤慧艳 审核人:詹世平 课程负责人:尤慧艳