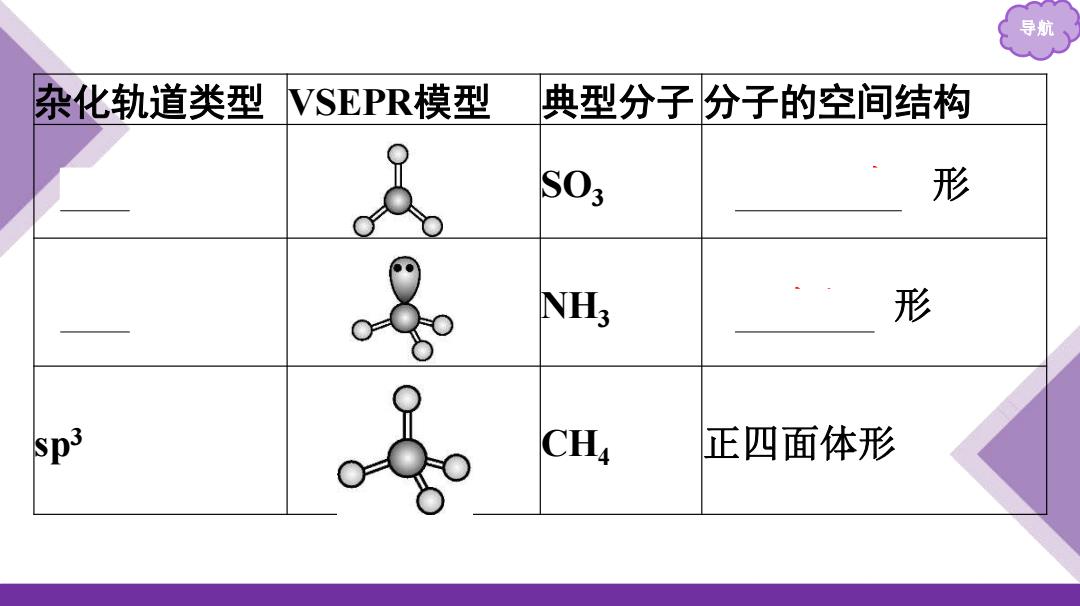
导航 杂化轨道类型 VSEPR模型 典型分子分子的空间结构 S03 形 NH; 形 Sp3 CH4 正四面体形
导航 杂化轨道类型 VSEPR模型 典型分子 分子的空间结构 sp2 SO3 平面三角 形 sp3 NH3 三角锥 形 sp3 CH4 正四面体形

导航 预习检测 1判断正误,正确的画“V”,错误的画“×”。 (1)所有原子轨道都参与杂化。(×) (2)杂化方式相同的分子,空间结构一定相同。(×) (3)并非任意两个原子轨道都能发生杂化。(√)
导航 预习检测 1.判断正误,正确的画“√”,错误的画“×” 。 (1)所有原子轨道都参与杂化。( ) (2)杂化方式相同的分子,空间结构一定相同。( ) (3)并非任意两个原子轨道都能发生杂化。( ) ✖ ✖ ✔
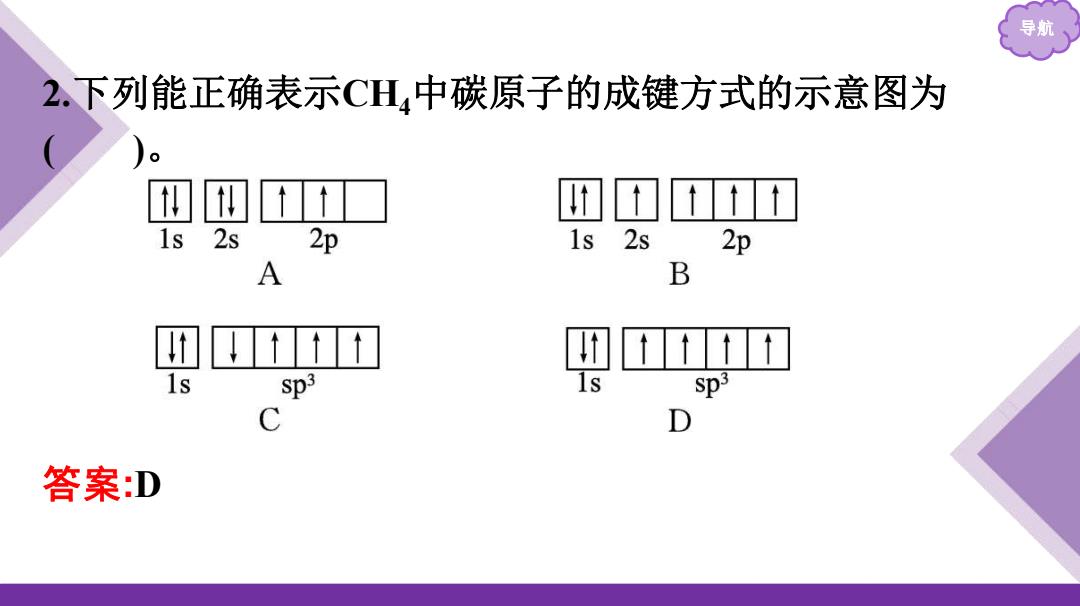
导航 2.下列能正确表示CH4中碳原子的成键方式的示意图为 t■ 1s 2s 2p 1s 2s 2p A B 团 t t 1s Sp3 sp3 C D 答案:D
导航 2.下列能正确表示CH4中碳原子的成键方式的示意图为 ( )。 答案:D

导航 解析:碳原子的2s轨道与2p轨道杂化形成4个能量相同、方向 不同的杂化轨道,因此碳原子的4个价电子分占在4个sp3杂化 轨道上,且自旋平行
导航 解析:碳原子的2s轨道与2p轨道杂化形成4个能量相同、方向 不同的杂化轨道,因此碳原子的4个价电子分占在4个sp3杂化 轨道上,且自旋平行

导 3.下列有关杂化轨道的说法不正确的是( )。 A.杂化前后的轨道数不变,但轨道的形状发生了改变 B.sp3、sp2、sp杂化轨道间的夹角分别为109°28、120°、 180° C.部分四面体形、三角锥形、V形分子的空间结构可以用sp3 杂化轨道解释 D.杂化轨道全部参与形成化学键 答案:D
导航 3.下列有关杂化轨道的说法不正确的是( )。 A.杂化前后的轨道数不变,但轨道的形状发生了改变 B.sp3 、sp2 、sp杂化轨道间的夹角分别为109°28'、120° 、 180° C.部分四面体形、三角锥形、V形分子的空间结构可以用sp3 杂化轨道解释 D.杂化轨道全部参与形成化学键 答案:D