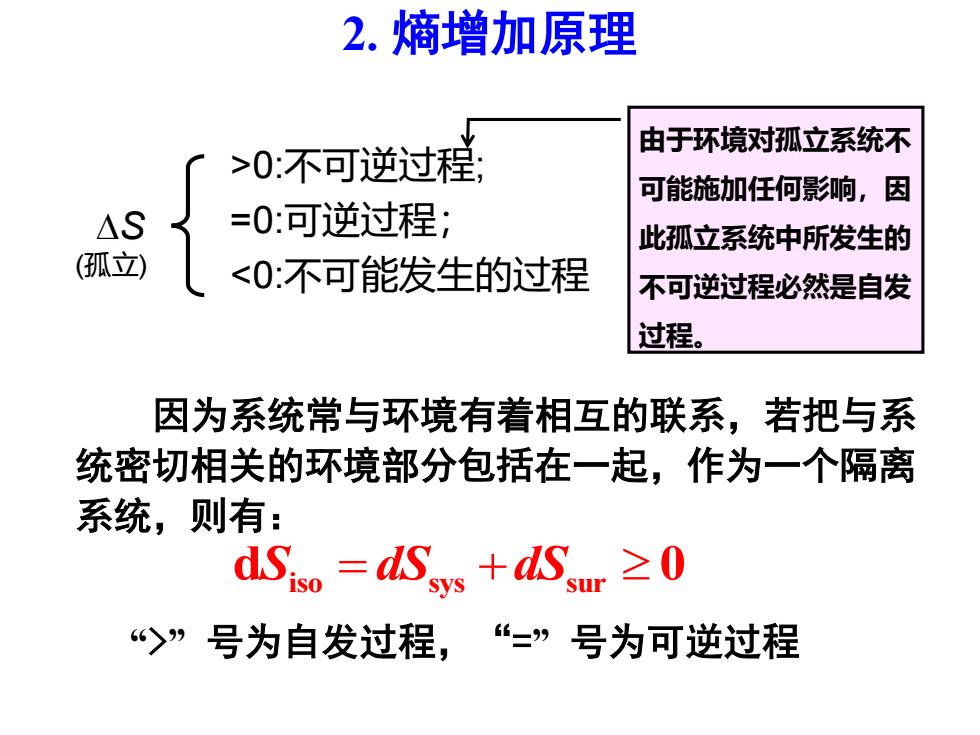
2.熵增加原理 由于环境对孤立系统不 >0不可逆过程; 可能施加任何影响,因 △S =0可逆过程; 此孤立系统中所发生的 孤立) <0:不可能发生的过程 不可逆过程必然是自发 过程。 因为系统常与环境有着相互的联系,若把与系 统密切相关的环境部分包括在一起,作为一个隔离 系统,则有: dSs。=dSs+dSur≥0 “>”号为自发过程,“=”号为可逆过程
S (孤立) >0:不可逆过程; =0:可逆过程; <0:不可能发生的过程 由于环境对孤立系统不 可能施加任何影响,因 此孤立系统中所发生的 不可逆过程必然是自发 过程。 2. 熵增加原理 因为系统常与环境有着相互的联系,若把与系 统密切相关的环境部分包括在一起,作为一个隔离 系统,则有: d 0 S dS dS iso sys sur = + “>” 号为自发过程,“=” 号为可逆过程

熵的特点 (1)熵是系统的状态函数,是广度性质。 (2)可以用Clausius不等式来判别过程的可逆性 (3)在绝热过程中,若过程是可逆的,则系统的熵 不变。若过程是不可逆的,则系统的熵增加。绝热不 可逆过程向熵增加的方向进行,当达到平衡时,熵达 到最大值。 (4)在任何一个隔离系统中,若进行了不可逆过程, 系统的熵就要增大,一切能自动进行的过程都引起熵 的增大。若系统已处于平衡状态,则其中的任何过程 皆一定是可逆的
(1)熵是系统的状态函数,是广度性质。 (3)在绝热过程中,若过程是可逆的,则系统的熵 不变。若过程是不可逆的,则系统的熵增加。绝热不 可逆过程向熵增加的方向进行,当达到平衡时,熵达 到最大值。 (2)可以用Clausius不等式来判别过程的可逆性 熵的特点 (4)在任何一个隔离系统中,若进行了不可逆过程, 系统的熵就要增大,一切能自动进行的过程都引起熵 的增大。若系统已处于平衡状态,则其中的任何过程 皆一定是可逆的

§3.6热力学基本方程与T-S图 1.热力学的基本方程 第一定律与第二定律的联合公式 根据热力学第一定律 dU=δO+δW 若考虑无非膨胀功 的可逆过程 dU=δ2-pdV 根据热力学第二定律 2R ds= δ2k=TdS T 所以有 dU=Tas-pdy Tas=dU+pdv 这是热力学第一与第二定律的联合公式,也 称为热力学基本方程
§3.6 热力学基本方程与T-S图 1.热力学的基本方程—— 第一定律与第二定律的联合公式 根据热力学第一定律 若考虑无非膨胀功 的可逆过程 dU Q W = + δ δ R dU Q p V = − δ d 根据热力学第二定律 Q S Q T S T = = R R δ d δ d 所以有 d d d U T S p V = − T S U p V d d d = + 这是热力学第一与第二定律的联合公式,也 称为热力学基本方程

熵是热力学能和体积的函数,即S=S(U,V) ds- as (dΨ 热力学基本方程可表示为 ds=-dU+Pdv 所以有 或 as 或p=T as av)
熵是热力学能和体积的函数,即 S S U V = ( , ) V U S S S U V U V = + d d d 热力学基本方程可表示为 1 p S U V T T d d d = + 所以有 1 V S U T = V U T S = 或 U S p V T = U S p T V = 或
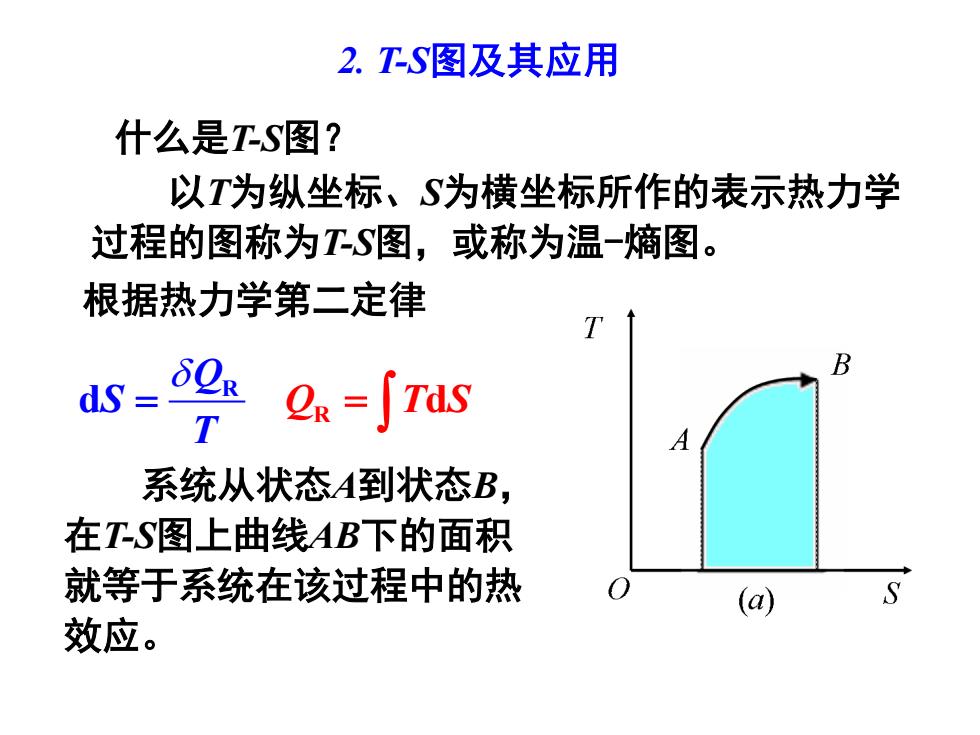
2.TS图及其应用 什么是TS图? 以T为纵坐标、S为横坐标所作的表示热力学 过程的图称为T-S图,或称为温-熵图。 根据热力学第二定律 B dS= 2=∫TdS A 系统从状态A到状态B, 在TS图上曲线AB下的面积 就等于系统在该过程中的热 (a) 效应
2. T-S图及其应用 Q S T = R d 根据热力学第二定律 系统从状态A到状态B, 在T-S图上曲线AB下的面积 就等于系统在该过程中的热 效应。 什么是T-S图? 以T为纵坐标、S为横坐标所作的表示热力学 过程的图称为T-S图,或称为温-熵图。 Q T S = R d