
三多原子分子的分子轨道 多原子分子的分子轨道也可用原子轨道线性组合而形成。 但是 在组合成分子轨道时,必须先将配位体 原子轨道进行组合得到配体群轨道“group orbits”,然后将这种群轨道当作单个原子的 原子轨道,使之与中心原子相同对称性的原 子轨道组合得到成键和反键的分子轨道,其 余对称性不匹配的轨道则成为非键轨道
在组合成分子轨道时,必须先将配位体 原子轨道进行组合得到配体群轨道“group orbits”,然后将这种群轨道当作单个原子的 原子轨道,使之与中心原子相同对称性的原 子轨道组合得到成键和反键的分子轨道,其 余对称性不匹配的轨道则成为非键轨道。 三 多原子分子的分子轨道 但是 多原子分子的分子轨道也可用原子轨道线性组合而形成

以BH为例,根据价电子对互斥理论, 可以推得BeH,分子为直线型结构。 H Be 按分子轨道理论的观点,参加组成分子 轨道的原子轨道有两个H原子的1s和Be原 线形BerL,) 子的一条2s、三条2p轨道,共6条轨道。很 显然,两个H的两条1s可以同Be的2s头对头 重叠组成o和σ、*分子轨道、两条1s也可以 同Be的2p,组成重叠良好的o,和o、*两条分子 轨道,但H的1s不能与Be的p、p,进行有效 的重叠,所以Be的2p、2p成为非键轨道。 BH,分子有四个价电子,依次填入两条成 π对称 对称 键轨道,在非键和反键中均没有电子,因 此,该分子是稳定的。该分子键级等于2。 而且电子都已自旋成对,分子具有反磁性。 再如H2O,根据价电子对互斥理论, Py、P2 保 H,0分子有V形的结构。 持非键
再如H2O,根据价电子对互斥理论, H2O分子有V形的结构。 以BeH2为例,根据价电子对互斥理论, 可以推得BeH2分子为直线型结构。 按分子轨道理论的观点, 参加组成分子 轨道的原子轨道有两个H原子的1s和Be原 子的一条2s、三条2p轨道, 共6条轨道。很 显然, 两个H的两条1s可以同Be的2s头对头 重叠组成s和s *分子轨道、两条1s也可以 同Be的2px组成重叠良好的x和x *两条分子 轨道,但H的1s不能与Be的py、pz进行有效 的重叠,所以Be的2py、 2pz成为非键轨道。 BeH2分子有四个价电子, 依次填入两条成 键轨道,在非键和反键中均没有电子, 因 此, 该分子是稳定的。该分子键级等于2。 而且电子都已自旋成对, 分子具有反磁性。 s-s-s s-px-s py、pz 保 持非键 称 节 面
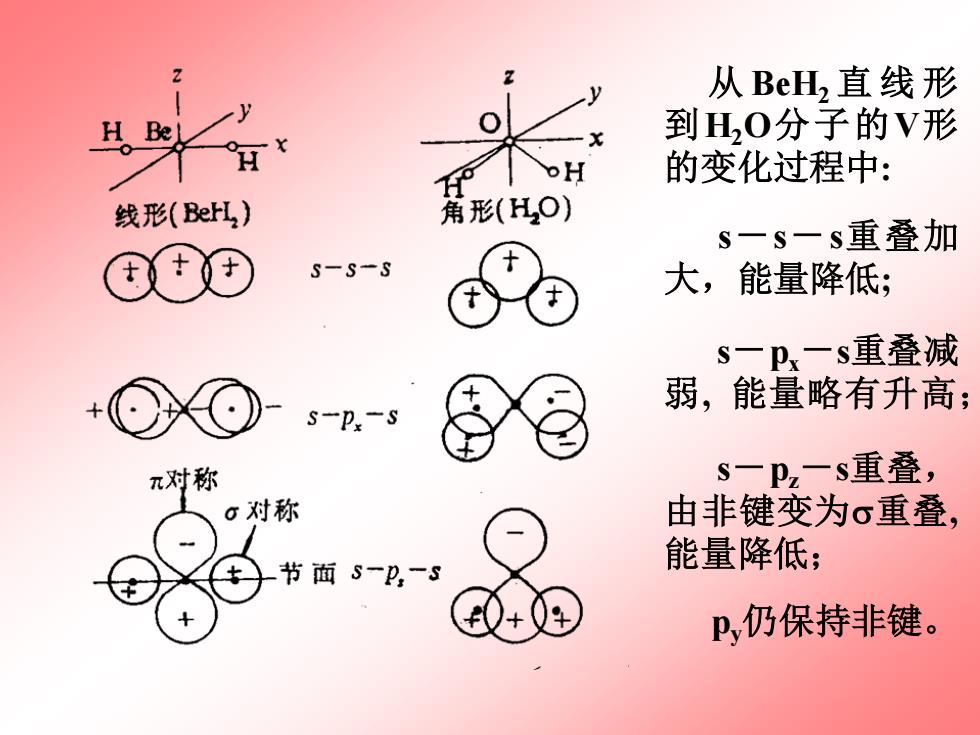
从BeH,直线形 到H,0分子的V形 H 的变化过程中: 线形(BerH,) 角形(HO) s一s一s重叠加 S-S-S 大,能量降低; S一Px一s重叠减 弱,能量略有升高; s-P-S π对称 S一Pz一s重叠, 6对称 由非键变为σ重叠, 节面S一p一S 能量降低: P,仍保持非键
从 BeH2 直线形 到H2O分子的V形 的变化过程中: s-s-s重叠加 大,能量降低; s-px-s重叠减 弱, 能量略有升高; s-pz-s重叠, 由非键变为重叠, 能量降低; py仍保持非键
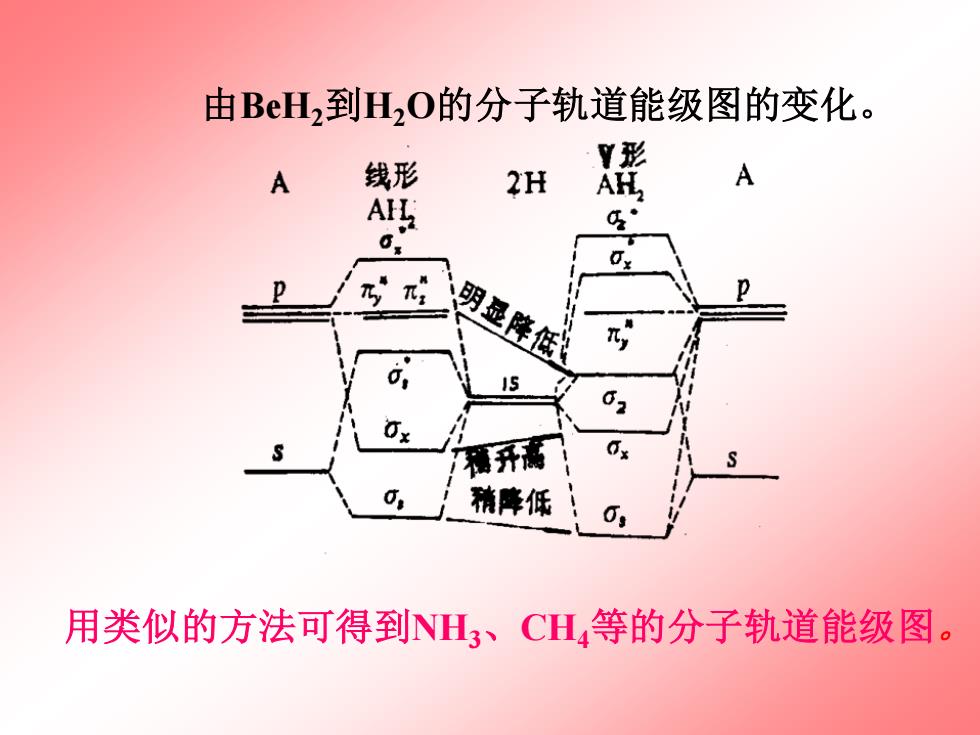
由BH2到H2O的分子轨道能级图的变化。 线形 形 2H A g· 明是降低 0 精库低 用类似的方法可得到NH3、CH,等的分子轨道能级图
由BeH2到H2O的分子轨道能级图的变化。 用类似的方法可得到NH3、CH4等的分子轨道能级图

五缺电子分子的分子轨道 缺电子分子是指分子中的电子数少于成键轨道 所能容纳的电子数的分子。 如B的价轨道是1条2s和3条2p,但B本身只有3个电 子,不能给每条轨道都提供一个电子。这样的原子称为 缺电子原子。这些原子形成分子时, 一方面可由其它原子提供电子来填充,如BH4ˉ
五 缺电子分子的分子轨道 缺电子分子是指分子中的电子数少于成键轨道 所能容纳的电子数的分子。 如B的价轨道是1条2s和3条2p, 但B本身只有3个电 子,不能给每条轨道都提供一个电子。这样的原子称为 缺电子原子。这些原子形成分子时, 一方面可由其它原子提供电子来填充, 如BH4 -